CUSTOMER
客户中心
助力生命健康领域从基础研究到产业化的加速转化
From:Nature ,IF =48.9
Abstract

Metastasis is the spread of cancer cells from primary tumours to distant organs and is the cause of 90% of cancer deaths globally1,2. Metastasizing cancer cells are uniquely vulnerable to immune attack, as they are initially deprived of the immunosuppressive microenvironment found within established tumours3. There is interest in therapeutically exploiting this immune vulnerability to prevent recurrence in patients with early cancer at risk of metastasis. Here we show that inhibitors of cyclooxygenase 1 (COX-1), including aspirin, enhance immunity to cancer metastasis by releasing T cells from suppression by platelet-derived thromboxane A2 (TXA2). TXA2 acts on T cells to trigger an immunosuppressive pathway that is dependent on the guanine exchange factor ARHGEF1, suppressing T cell receptor-driven kinase signalling, proliferation and effector functions. T cell-specific conditional deletion of Arhgef1 in mice increases T cell activation at the metastatic site, provoking immune-mediated rejection of lung and liver metastases. Consequently, restricting the availability of TXA2 using aspirin, selective COX-1 inhibitors or platelet-specific deletion of COX-1 reduces the rate of metastasis in a manner that is dependent on T cell-intrinsic expression of ARHGEF1 and signalling by TXA2 in vivo. These findings reveal a novel immunosuppressive pathway that limits T cell immunity to cancer metastasis, providing mechanistic insights into the anti-metastatic activity of aspirin and paving the way for more effective anti-metastatic immunotherapies.
摘要
转移是指癌细胞从原发肿瘤扩散至远端器官,是全球90%癌症死亡的直接原因。转移初期的癌细胞因缺乏已建立肿瘤中的免疫抑制微环境,对免疫攻击尤为敏感。目前,如何利用这一免疫易感性以预防早期癌症患者的转移复发,已成为研究热点。
本研究发现,环氧化酶-1(COX-1)抑制剂(包括阿司匹林)可通过阻断血小板来源的血栓素A2(TXA2)对T细胞的抑制作用,显著增强机体抗转移免疫。机制上,TXA2通过激活鸟嘌呤核苷酸交换因子ARHGEF1,触发免疫抑制通路,从而抑制T细胞受体(TCR)介导的激酶信号、增殖及效应功能。小鼠模型中,T细胞特异性敲除Arhgef1可显著增强转移灶中T细胞活化,从而引发免疫介导的肺、肝转移灶清除。
进一步实验证实,通过阿司匹林、选择性COX-1抑制剂或血小板特异性敲除COX-1限制TXA2生成,均可降低转移发生率,且该效应依赖于T细胞内源性ARHGEF1及TXA2信号传导。本研究揭示了一条限制T细胞抗转移免疫的全新免疫抑制通路,阐明了阿司匹林抗转移作用的分子机制,并为开发更有效的抗转移免疫疗法奠定基础。
内容总结
1. ARHGEF1缺失显著抑制转移
多模型验证:
B16黑色素瘤(静脉注射):Arhgef1基因敲除(KO)小鼠肺转移结节减少50-80%(P<0.001)。
LL/2肺癌、MC38肠癌:转移灶面积显著缩小(P<0.01)。
自发性MMTV-PyMT乳腺癌模型:肺转移减少40%(P=0.006),原发肿瘤生长无差异。
2. 免疫机制明确
T细胞依赖性:T细胞特异性Arhgef1缺失(Cd4cre)即可重现抗转移效果(图1k),而NK/巨噬细胞缺失无效。
Arhgef1 KO的T细胞表现为:功能增强:多细胞因子(IFN-γ/TNF/IL-2)共表达比例↑3倍(图2b)。
耗竭减少:PD-1⁺TIM3⁺耗竭T细胞比例↓60%(图2h)。
3. TXA2-ARHGEF1通路直接抑制T细胞
体外实验:
TXA2类似物(U46619)抑制野生型T细胞增殖(96.6%→44.0%),但对Arhgef1 KO细胞无影响(图3d)。
信号阻断:TXA2通过TP受体→ARHGEF1→RHOA→PTEN轴抑制TCR下游的AKT/S6/ERK磷酸化(图4c-g)。
4. 阿司匹林疗效验证
机制依赖:阿司匹林仅对野生型小鼠减少转移(结节数↓60%,P=0.02),而对T细胞Arhgef1缺失小鼠无效(图5c)。
TXA2类似物可逆转阿司匹林效果(图5e)。
靶点特异性:COX-1抑制剂(SC-560)能够模拟阿司匹林的效果,而COX-2抑制剂(Celecoxib)无效(图5g-h)。血小板特异性COX-1缺失(Pf4crePtgs1fl/fl)减少转移50%(图5j)。
5. 临床关联性
人类数据支持:回顾性分析显示,阿司匹林降低癌症转移风险(HR=0.64,95% CI 0.48-0.84),尤其对HLA-I高表达肿瘤有效(参考文献6,9)。
6. 关键结论
血小板TXA2通过ARHGEF1抑制T细胞是转移逃逸的核心机制;阿司匹林通过阻断该通路释放T细胞免疫,为低成本抗转移策略提供理论依据。
图文摘要
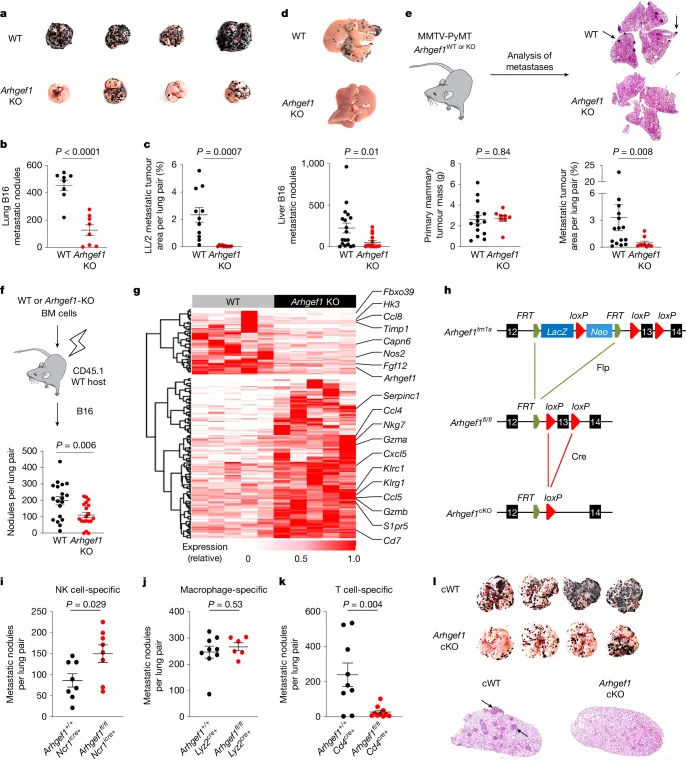
图1 | ARHGEF1抑制T细胞介导的抗肿瘤转移免疫
a–b:野生型(WT;n=8)与Arhgef1敲除(KO;n=8)小鼠尾静脉注射B16黑色素瘤细胞后肺部转移结节的代表性照片(a)与定量(b)。
c:野生型(n=11)与Arhgef1-KO(n=10)小鼠尾静脉注射LL/2肺癌细胞后肺部转移灶面积百分比。
d:野生型(n=18)与Arhgef1-KO(n=16)小鼠脾脏注射B16细胞后肝脏转移结节的代表性照片(上)与定量(下)。
e:Arhgef1野生型或敲除MMTV-PyMT小鼠模型的示意图(左上)、原发乳腺肿瘤质量(左下)、肺部H&E染色(右上)及转移灶面积百分比(右下)。
f:骨髓重建实验示意图(上)与野生型(n=19)或Arhgef1-KO(n=19)骨髓重建小鼠肺部转移结节频率(下)。
g:野生型(n=5)与Arhgef1-KO(n=5)小鼠肺部肿瘤组织差异表达基因热图(q<0.05,|FC|>2)。
h:Arhgef1条件性敲除(cKO)等位基因构建示意图。
i–k:不同细胞系特异性Arhgef1敲除(NK细胞、巨噬细胞、T细胞)后肺部转移结节频率。
l:Cd4Cre(cWT)与Cd4Cre Arhgef1fl/fl(Arhgef1-cKO)小鼠肺部转移结节照片与H&E染色。
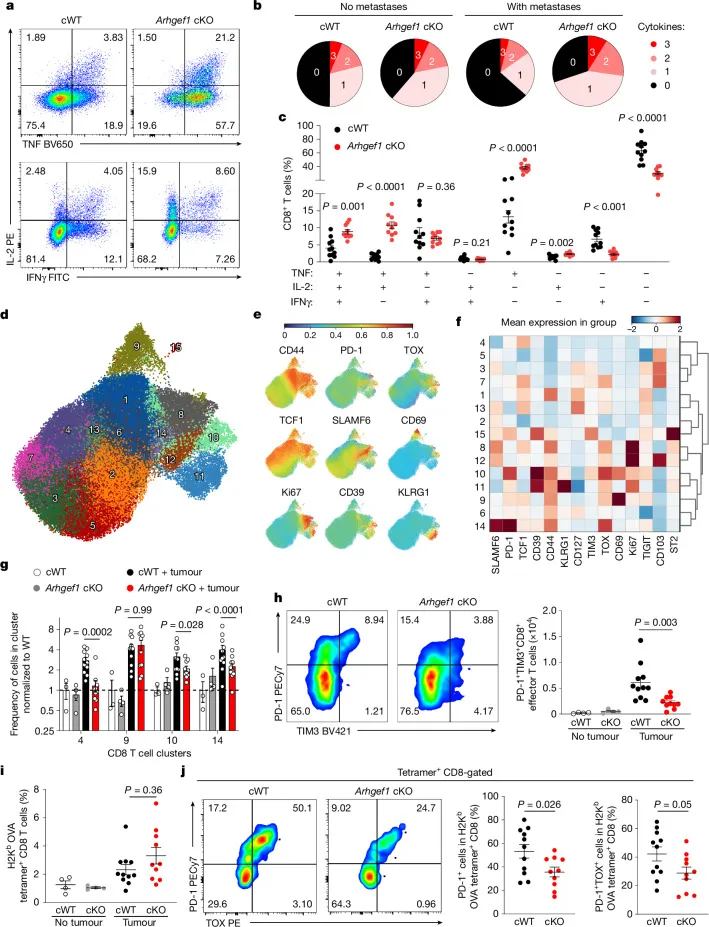
图2 | ARHGEF1缺失增强CD8+ T细胞的多功能性
a–c:Arhgef1-cKO小鼠肺部CD8+ T细胞在肿瘤存在下表达TNF、IL-2和IFNγ的多功能性分析。
d–h:高维流式细胞术分析肺部CD8+ T细胞亚群(UMAP聚类),包括PD-1、TIM3、TCF1等标志物表达。
i–j:OVA特异性CD8+ T细胞频率及其PD-1、TOX表达水平。
图3 | TXA2通过ARHGEF1抑制T细胞激活与增殖
a:T细胞表达的Gα12/13偶联GPCR及其配体列表。
b:体外筛选GPCR配体对T细胞激活的影响,发现TXA2类似物U46619抑制T细胞激活且依赖ARHGEF1。
c–e:TXA2类似物抑制野生型而非Arhgef1-KO CD8+ T细胞增殖与激活。
f:CRISPR敲除Tbxa2r(TXA2受体)后,TXA2对T细胞的抑制作用消失。
g:TP抑制剂可逆转TXA2对T细胞增殖的抑制作用。
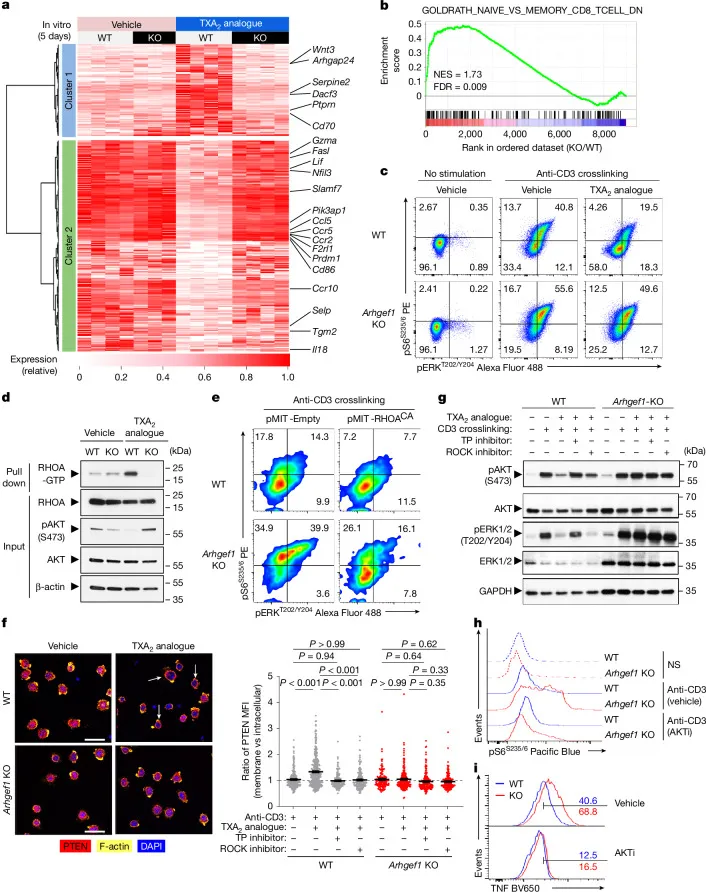
图4 | TXA2通过TP-ARHGEF1-RHOA轴抑制TCR下游信号
a:TXA2抑制T细胞激活相关基因表达(依赖ARHGEF1)。
b:TXA2处理后,Arhgef1-KO细胞富集记忆型T细胞基因特征。
c:TXA2抑制TCR诱导的S6和ERK磷酸化,依赖ARHGEF1。
d:TXA2诱导野生型T细胞中RHOA-GTP活性,Arhgef1-KO中无此现象。
e:RHOA-Q63L(组成型激活)可恢复Arhgef1-KO细胞的信号抑制。
f:TXA2诱导PTEN向细胞膜募集,依赖TP与ROCK。
g:TXA2抑制AKT和ERK磷酸化,分别依赖PTEN/ROCK与ARHGEF1。
h–i:AKT抑制剂可抑制Arhgef1-KO T细胞的过度激活。
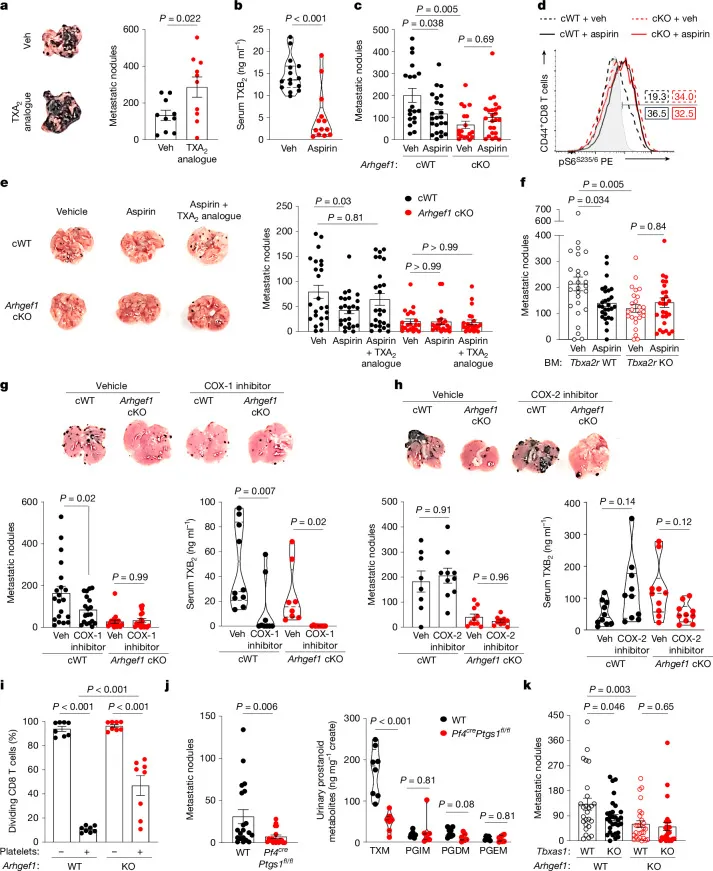
图5 | 阿司匹林通过阻断TXA2释放T细胞介导的抗肿瘤转移免疫
a:TXA2类似物U46619增加肺部转移结节。
b:阿司匹林降低血清TXB2(TXA2代谢物)水平。
c:阿司匹林减少野生型而非Arhgef1-cKO小鼠的转移结节。
d:阿司匹林增强野生型T细胞的S6磷酸化能力,Arhgef1-cKO中无差异。
e:TXA2类似物可逆转阿司匹林的抗转移作用。
f:阿司匹林抗转移作用依赖造血细胞TP表达。
g–h:COX-1抑制剂(非COX-2抑制剂)模拟阿司匹林抗转移作用,并降低TXB2。
i:血小板与T细胞共培养抑制T细胞激活,部分依赖ARHGEF1。
j:血小板特异性COX-1敲除(Pf4cre Ptgs1fl/fl)减少转移并降低TXM。
k:TXA合成酶(Tbxas1)缺失减少转移,但在Arhgef1-KO中无影响。
参考文献:
Yang J, Yamashita-Kanemaru Y, Morris BI, Contursi A, Trajkovski D, Xu J, Patrascan I, Benson J, Evans AC, Conti AG, Al-Deka A, Dahmani L, Avdic-Belltheus A, Zhang B, Okkenhaug H, Whiteside SK, Imianowski CJ, Wesolowski AJ, Webb LV, Puccio S, Tacconelli S, Bruno A, Di Berardino S, De Michele A, Welch HCE, Yu IS, Lin SW, Mitra S, Lugli E, van der Weyden L, Okkenhaug K, Saeb-Parsy K, Patrignani P, Adams DJ, Roychoudhuri R. Aspirin prevents metastasis by limiting platelet TXA2 suppression of T cell immunity. Nature. 2025 Apr;640(8060):1052-1061. doi: 10.1038/s41586-025-08626-7. Epub 2025 Mar 5. PMID: 40044852; PMCID: PMC12018268.