SERVICE
技术服务
高质量的数据和快速的周转期以支持各项药物开发、临床前研究和临床研究
概述
细胞衰老(Cellular senescence)源于细胞受到各类刺激后的不可逆反应,使得细胞周期停滞不前。在生物体的生长和发育过程中,以及在遭受损伤之后,细胞衰老发挥着至关重要的角色,推动组织的重塑与再生。然而,这种生理过程并非全然有益,它也可能引发组织再生能力的下降,以及功能的逐步退化。随着时间的推移,这些变化可能导致生物体出现炎症反应和肿瘤形成的风险。
细胞衰老各种机制及诱导刺激
细胞衰老是一个复杂的过程,涉及多种机制和诱导刺激。主要分为复制性衰老和非复制性衰老两大类:一、复制性衰老:端粒缩短的连锁反应,是由细胞分裂过程中端粒逐渐缩短引起的。端粒的侵蚀使得染色体末端对胁迫因子更为敏感,进而促进了衰老相关性状的逐步发展。二、非复制性衰老是由衰老和病理过程中出现的多种压力因素触发的(如下)。
(1)DNA损伤与细胞周期阻滞:DNA损伤可激活DNA损伤响应(DDR),通过ATM或ATR蛋白激酶的激活导致细胞周期阻滞。这一过程表明p53的稳定性和p21表达的增强,进而抑制周期蛋白依赖性激酶2,使Rb蛋白保持附着状态,从而抑制E2F(G1到S相变诱导的转录因子)的活性。
(2)旁分泌诱导的衰老:旁分泌诱导的衰老是由邻近衰老细胞分泌的SASP(衰老相关分泌表型)成分介导的。例如,IL-6与其受体两个GP130分子复合物的结合,可激活JAK-STAT信号通路,从而引发衰老。
(3)线粒体功能障碍相关衰老(MIDAS):线粒体功能障碍是细胞衰老的另一种独特类型。功能失调的线粒体表现为低NAD1/NADH比率,通过p53促进生长停滞。此外,p53的激活还能通过非NF-kB依赖的机制下调IL-1依赖性炎症臂,调节SASP,并促进CCL27、TNFa和IL10等其他因子的表达。
(4)OIS与肿瘤抑制:OIS(复制性衰老)通过抑制肿瘤细胞增殖发挥内在抑制作用。癌基因激活和肿瘤抑制因子的抑制均可导致DNA损伤,进而通过p53/p21和p16INK4a通路激活导致不可逆的生长停滞。
(5)表观遗传诱导的衰老:包括sahf(衰老相关的异染色质凝聚)的形成,以及H3k9me2/3等特殊结构域的形成。这些结构域的形成是由于先前存在的抑制标记在空间上重新定位到增殖诱导基因的启动子位点。
(6)氧化应激诱导的衰老:ROS的产生,如内质网应激,可导致DNA和mtDNA损伤,分别触发DDR和MIDAS。
(7)化疗诱导的衰老:肿瘤细胞在接受化疗药物后,往往缺乏衰老相关的肿瘤抑制因子,如p53和Rb。这导致衰老相关的形态学特征,如细胞骨架异常的扩大和扁平形式(图1)[1]。
(https://pubmed.ncbi.nlm.nih.gov/36732079/)
 图1 细胞衰老各种机制及诱导刺激[1]
图1 细胞衰老各种机制及诱导刺激[1]
衰老信号通路调控的标志
调控机制在细胞内以三个精细的水平展开:
(1)在遗传与表观遗传水平上,p16-Rb通路至关重要,其调控涉及多种复杂的修饰转录机制。例如,组蛋白修饰、DNA甲基化以及关键转录因子的精准募集,这些机制共同决定基因的表达状态;
(2)在mRNA水平上,mTOR与AMPK通路发挥着核心作用。这一层面的调控涉及mRNA的稳定性、降解速率,以及核糖体的有效募集,这些因素共同影响蛋白质的翻译过程;
(3)在蛋白质水平上,SASP通路与自噬-溶酶体通路是调控的关键。这一层面的调控包括蛋白质翻译后的修饰、降解过程,以及蛋白质在细胞内的转运机制(图2)[2]。
(https://pubmed.ncbi.nlm.nih.gov/29477613/)
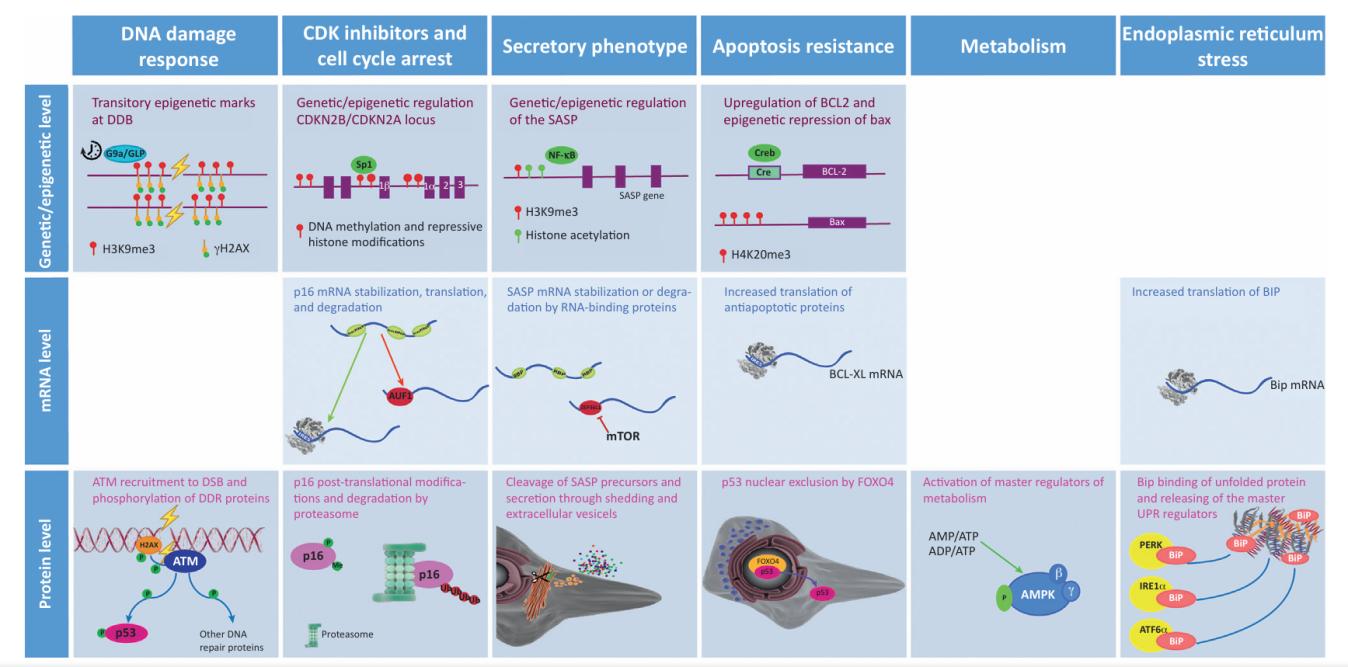 图2 衰老信号通路调控[2]
图2 衰老信号通路调控[2]
细胞衰老和疾病研究
成人细胞的持续衰老现象,至少在与人类健康密切相关的三种不同环境中显现:正常的生理老化、与年龄相关的疾病以及治疗干预过程。在所谓的“健康”老化过程中,尽管个体差异存在,但组织功能退化普遍发生。而与年龄紧密相连的特定疾病,却只会侵袭部分人群。
在老化的过程中,维持组织稳态所需的生理机制不可避免地会引发损伤,从而推动衰老的进程。这些持续存在的老化细胞,其成因多样:一方面,可能是由于免疫系统的老化导致其清除功能缺陷;另一方面,也可能是因为衰老细胞缺乏有效的信号传导,未能吸引免疫细胞进行清除。
此外,由伤口修复、肿瘤抑制等生理过程产生的急性衰老细胞,亦可能因老化免疫系统的处理能力不足而持续存在。这些老化细胞,由多种复杂机制产生,它们在降低组织功能的同时,也使老化组织在遭遇其他压力因素时,更加脆弱,易于进一步恶化(图3)[3]。(https://pubmed.ncbi.nlm.nih.gov/26646499/)
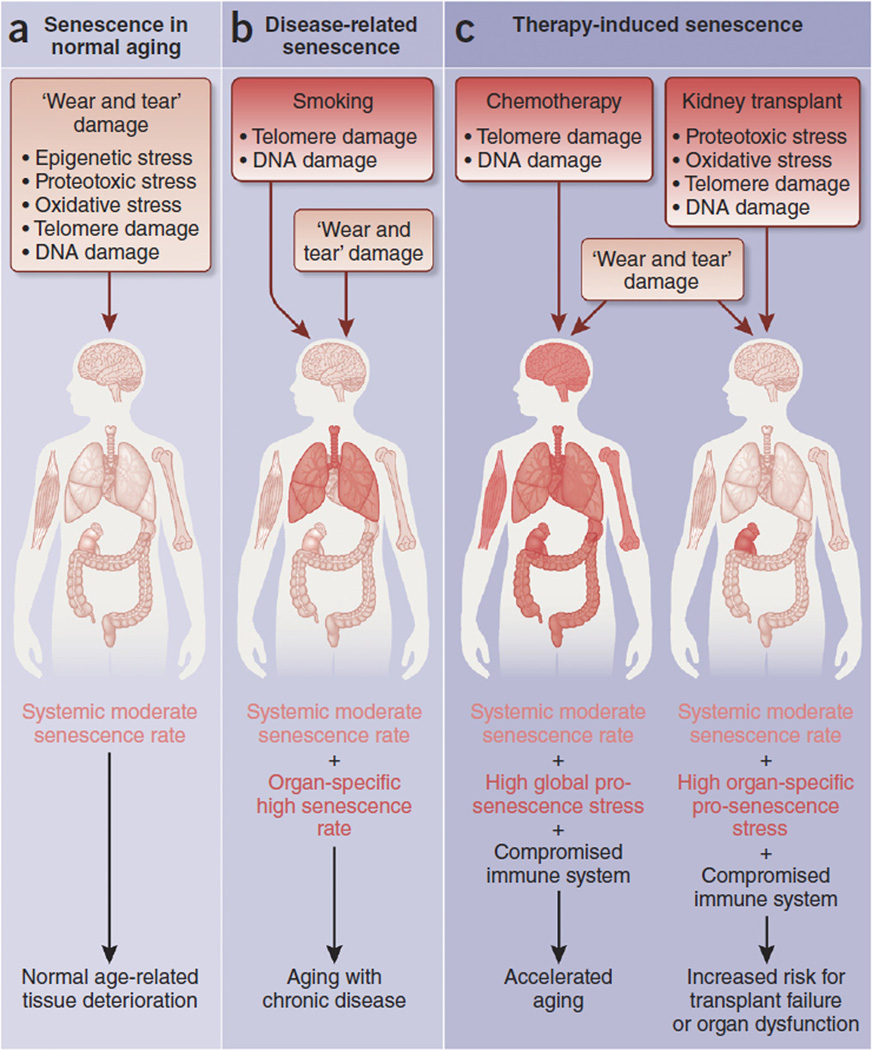 图3 衰老与疾病研究[3]
图3 衰老与疾病研究[3]
参考文献:
[1] Lucas V, Cavadas C, Aveleira CA. Cellular Senescence: From Mechanisms to Current Biomarkers and Senotherapies. Pharmacol Rev. 2023 Jul;75(4):675-713. doi: 10.1124/pharmrev.122.000622. Epub 2023 Feb 2. PMID: 36732079.
[2] Hernandez-Segura A, Nehme J, Demaria M. Hallmarks of Cellular Senescence. Trends Cell Biol. 2018 Jun;28(6):436-453. doi: 10.1016/j.tcb.2018.02.001. Epub 2018 Feb 21. PMID: 29477613.
[3] Childs BG, Durik M, Baker DJ, van Deursen JM. Cellular senescence in aging and age-related disease: from mechanisms to therapy. Nat Med. 2015 Dec;21(12):1424-35. doi: 10.1038/nm.4000. PMID: 26646499; PMCID: PMC4748967.