SERVICE
技术服务
高质量的数据和快速的周转期以支持各项药物开发、临床前研究和临床研究
概述
细胞焦亡(Pyroptosis)是一种溶解性和炎症性的程序性细胞死亡,通常由炎性小体触发并由gasdermin家族蛋白执行。细胞焦亡的主要特征是细胞肿胀、膜穿孔和细胞内容物的释放而引发炎症反应。细胞焦亡在宿主防御病原体感染方面起着关键作用。但是,过度的焦亡可能会导致持续的炎症反应,从而导致炎症性疾病的发生。
Gasdermins:焦亡效应器
焦亡是由炎性小体引发的一种裂解性程序性细胞死亡,Gasdermin家族蛋白是细胞焦亡的关键执行分子,该家族包括GSDMA、GSDMB、GSDMC、GSDMD、GSDME和DFNB59。Caspase-1或Caspase-11/4/5的激活,可裂解gasdermin家族蛋白,将其N端成孔结构域(PFD)与C端阻遏结构域(RD)分离。PFD寡聚化在膜中形成大孔,从而导致肿胀和膜穿孔。例如,Caspase-1/11激活gasdermin D引起细胞焦亡(图1)[1]。(https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5565696/)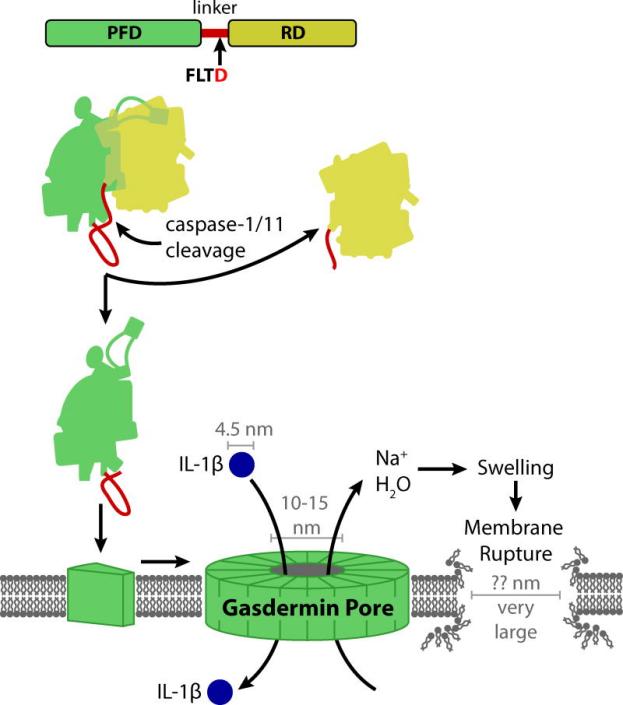 图1 Caspase-1/11激活gasdermin D引起细胞焦亡[1]
图1 Caspase-1/11激活gasdermin D引起细胞焦亡[1]
焦亡机制
目前,已确定的诱导焦亡的主要四种不同的信号通路,包括经典和非经典炎性小体通路、凋亡caspase介导的通路和颗粒酶的通路。在这些信号通路中,被上游caspase或颗粒酶裂解的gasdermin蛋白是最终的执行者。以下是四种焦亡的信号通路:
(1)在经典的炎性小体途径中,病原体或损伤相关分子模式(如病毒、细菌、毒素、ATP或ROS)刺激炎性小体,然后激活caspase-1裂解GSDMD以形成孔,最终导致炎症反应和焦亡。经典的炎性小体途径介导的细胞焦亡主要发生在免疫细胞中,是宿主抵御病原体感染的机制。
(2)来自革兰氏阴性菌的LPS直接激活caspase-4/5/11,然后进行GSDMD裂解,在非经典炎性小体途径中执行焦亡。
(3)凋亡caspase介导的焦亡通路可通过caspase-3/GSDME、caspase-8/GSDMC、caspase-6/GSDMB等机制参与,去除C端阻遏结构域,导致N端效应结构域的释放,从而穿孔细胞膜并最终引起细胞焦亡。
(4)在颗粒酶介导的途径中,源自细胞毒性淋巴细胞的GZMA或GZMB可以分别裂解GSDMB或GSDME以进行孔形成和焦亡。颗粒酶介导的癌细胞焦亡可能会放大肿瘤微环境(TME)中的炎症反应,从而募集更多的免疫细胞进行抗肿瘤免疫[2]。(https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9169370/)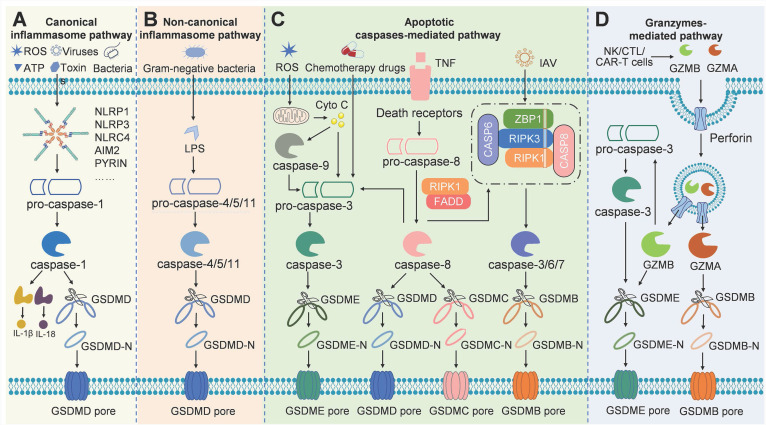 图2 不同焦亡途径[2]
图2 不同焦亡途径[2]
焦亡与癌症治疗研究
焦亡在肿瘤发展和抗肿瘤免疫中起着至关重要的作用,是一把双刃剑,可以促肿瘤也可以抑制肿瘤。一方面,慢性细胞焦亡会触发促炎细胞因子,导致肿瘤生长。例如,GSDME介导的细胞焦亡通过释放高迁移率族箱蛋白1(HMGB1)促进结肠炎相关结直肠癌的发展,该蛋白通过ERK1/2通路诱导肿瘤细胞增殖和抗原表达。
另一方面,急性细胞焦亡导致大量免疫细胞浸润,这不仅诱导大量癌细胞死亡,还会激活抗肿瘤免疫以抑制肿瘤生长。焦亡的抗肿瘤免疫涉及很多方面,首先是释放损伤相关分子模式和炎性细胞因子,直接调节先天免疫反应,以增强适应性免疫细胞的募集以及抗原呈递的增加,从而导致广泛的免疫激活。释放的炎性细胞因子IL-1β可诱导树突状细胞(DC)成熟,激活CD8+T细胞,并抑制免疫抑制性T调节细胞的分化。IL-18在自然杀伤(NK)细胞募集和激活以及Th-1极化中起关键作用。所有这些都会改变免疫抑制微环境并增加肿瘤浸润淋巴细胞。因此,诱导急性和大量癌细胞焦亡是肿瘤治疗的潜在策略[3]。(https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8419056/)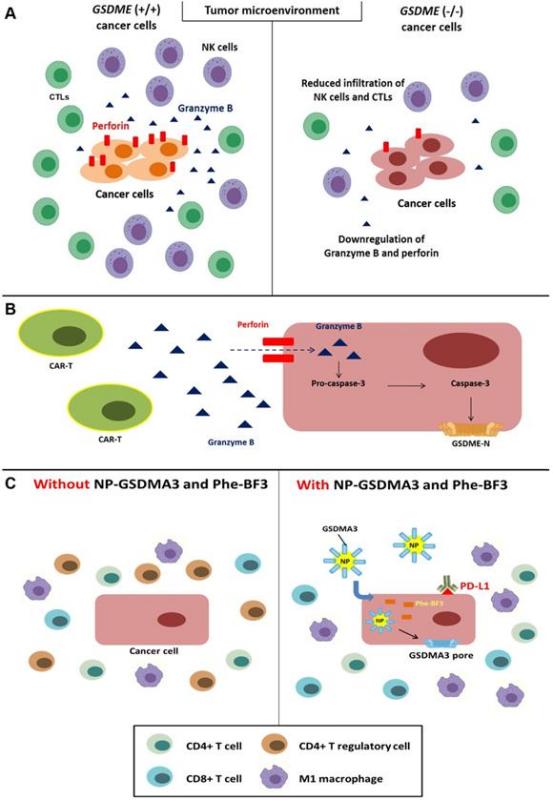 图3 焦亡与肿瘤免疫微环境之间的相关性[3]
图3 焦亡与肿瘤免疫微环境之间的相关性[3]
参考文献:
[1] Kovacs SB, Miao EA. Gasdermins: Effectors of Pyroptosis. Trends Cell Biol. 2017 Sep;27(9):673-684. doi: 10.1016/j.tcb.2017.05.005. Epub 2017 Jun 12. PMID: 28619472; PMCID: PMC5565696.
[2] Rao Z, Zhu Y, Yang P, Chen Z, Xia Y, Qiao C, Liu W, Deng H, Li J, Ning P, Wang Z. Pyroptosis in inflammatory diseases and cancer. Theranostics. 2022 May 16;12(9):4310-4329. doi: 10.7150/thno.71086. PMID: 35673561; PMCID: PMC9169370.
[3] Hsu SK, Li CY, Lin IL, Syue WJ, Chen YF, Cheng KC, Teng YN, Lin YH, Yen CH, Chiu CC. Inflammation-related pyroptosis, a novel programmed cell death pathway, and its crosstalk with immune therapy in cancer treatment. Theranostics. 2021 Aug 12;11(18):8813-8835. doi: 10.7150/thno.62521. PMID: 34522213; PMCID: PMC8419056.