SERVICE
技术服务
高质量的数据和快速的周转期以支持各项药物开发、临床前研究和临床研究
概述
炎症与免疫构成了机体对抗内外环境挑战的重要防线。在生理健康的背景下,这两大系统相互协调,维持着一种精细而微妙的平衡,以确保机体健康。
cGAS-STING通路作为免疫反应的核心机制,不仅激活免疫应答,还在炎症调节中发挥关键作用。适度的炎症反应是机体的一种自然防御手段,有助于抵御病原体。然而,当炎症反应失去控制,过度激活时,就可能导致免疫炎症反应,对健康造成严重影响。这些信号通路能够广泛影响心脏、肝脏、肺脏、肾脏等多个实质器官,加剧炎症性疾病的进程,从而加大治疗难度。此外,cGAS-STING通路与多种自身免疫性疾病的发病机制密切相关,如系统性红斑狼疮、类风湿性关节炎等,为这些疾病的研究和治疗提供了新的思路。
炎症的来源
炎症,作为多种生理及病理过程的根基,广泛存在于各类疾病之中。其诱因多样,经典如感染与组织损伤,它们是启动炎症反应的常见不利条件(图1)。当这些诱因出现时,它们会激发白细胞和血浆蛋白向受损部位聚集,以应对损伤。同时,组织压力的增大或功能障碍也会引发一系列适应性反应,这些反应主要依赖于组织内的巨噬细胞,它们构成了介于正常稳态与典型炎症反应之间的桥梁。炎症反应因触发因素的不同而展现出不同的生理目的和病理后果。在所有可能的初始刺激中,唯有感染所诱发的炎症与免疫反应的启动密切相关,共同构成了机体对抗病原体的关键机制。
炎症,实际上是高等生物在长期进化过程中,为应对微生物感染、组织损伤以及其他有害条件所形成的一种保护策略。它是宿主免疫系统的基本反应之一,不仅有助于清除有害刺激,还能促进受损组织的愈合。因此,急性炎症常被视为先天免疫的一部分,是宿主抵抗外来入侵者和有害分子的重要防线[1]。(https://www.nature.com/articles/nature07201)
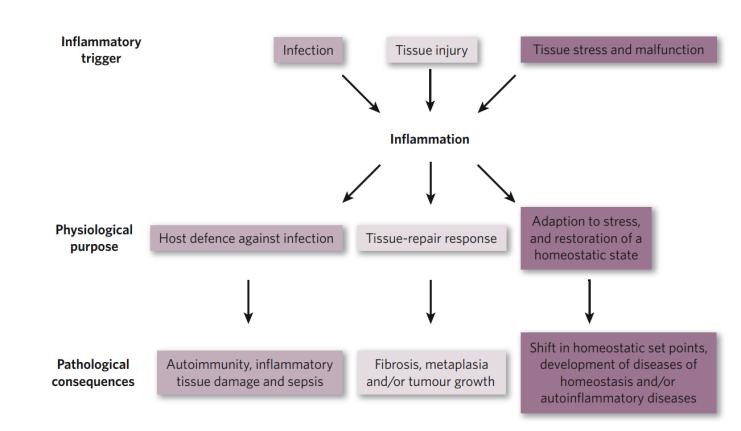 图1 炎症的原因、生理和病理结果[1]
图1 炎症的原因、生理和病理结果[1]
炎症的分子机制
炎症反应的起始,首先,宿主的细胞会通过一类特别的跨膜受体:模式识别受体(PRRs)来识别炎症刺激。这些受体广泛表达于先天免疫系统和适应性免疫系统的细胞上。炎症的启动,通常是由于病原体相关分子模式(PAMPs)或损伤相关分子模式(DAMPs)与这些受体的相互作用。这些模式识别受体包括Toll样受体(TLRs)、C-型凝集素受体(CLRs)、RIG-1样受体(RLRs)和NOD样受体(NLRs)。以Toll样受体(TLRs)为例,它们能够识别细菌细胞壁的成分,从而启动炎症信号传导路径。这一过程最终导致细胞因子TNF、IL-1β和趋化因子的释放,引导免疫细胞向炎症部位聚集。
免疫调节机制
免疫调节机制在维持人体内环境平衡中扮演着至关重要的角色。该机制涉及免疫系统内部各类免疫细胞与免疫分子的精密互动。在免疫细胞的大家族中,T细胞和B细胞是主要的调节者。调节性T细胞(Treg)则通过分泌抑制性细胞因子,如IL-10和TGF-β,巧妙地抑制免疫系统的过度激活,从而维护免疫系统的平衡状态。B细胞通过产生抗体和调节性细胞因子,积极参与免疫调节过程。这些细胞因子、抗体以及补体等免疫分子,在免疫调节网络中各司其职,发挥着重要作用。细胞因子之间形成了复杂的调节网络,相互协作,共同调控免疫细胞的功能。抗体通过与病原体或抗原的结合,有效发挥中和、调理及杀伤作用。补体系统则通过激活级联反应,参与到免疫防御和炎症调节的过程中。
cGAS-STING通路概述
免疫系统在维护生物体内环境稳定和健康方面扮演着至关重要的角色,它是我们机体对抗各类病原体的天然屏障。在这一复杂的防御机制中,cGAS-STING通路尤为重要,它能够响应细胞质中的DNA,激活先天免疫反应,从而增强我们对细菌和病毒的抵抗力。
具体来说,环状GMP-AMP合酶(cGAS)的活性,是由双链DNA(dsDNA)触发。这一催化过程,使得ATP和GTP转化为关键的免疫信号分子:2′3′-cGAMP。随后,2′3′-cGAMP与内质网(ER)的接头蛋白STING紧密结合,STING蛋白被精准地输送到内质网-高尔基体中间区室(ERGIC)及高尔基体。在此过程中,STING蛋白激活了IKK和TBK1两种关键的激酶。TBK1对STING进行磷酸化。磷酸化后的STING蛋白,进一步招募IRF3并使其磷酸化,磷酸化的IRF3形成二聚体,并进入细胞核。在细胞核内,IRF3与NF-kB携手合作,启动了I型干扰素和其他免疫调节分子的表达(图2)[2]。
(https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8029610/)
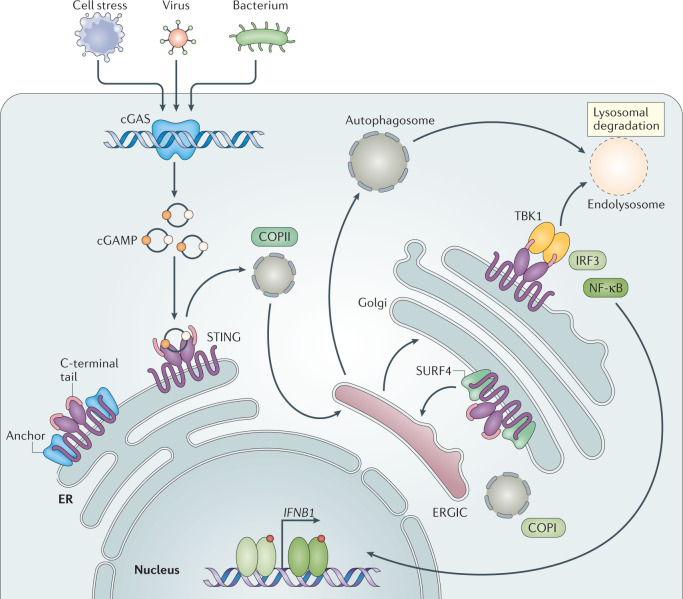 图2 cGAS-STING的信号通路[2]
图2 cGAS-STING的信号通路[2]
cGAS-STING通路激活调节炎症反应
细胞应激破坏了线粒体的平衡,促使线粒体通透性转换孔开启,线粒体DNA随之泄漏至细胞膜。这一过程触发了cGAS-STING信号传导途径的激活,进而引发炎症反应(图4)。在此过程中,炎性小体相关蛋白caspase-1、Gasdermin D、ASC的CARD结构域和钾通道共同参与调节cGAS-STING通路(图3)。尤为关键的是,这种相互作用形成了一个级联放大效应的串扰网络。该网络效应能显著增强免疫炎症反应,使炎症和自身免疫性疾病的病理过程进一步恶化。多项研究证实,这一机制在疾病的发生和发展中扮演了重要角色[3]。
(https://pubmed.ncbi.nlm.nih.gov/38195584/)
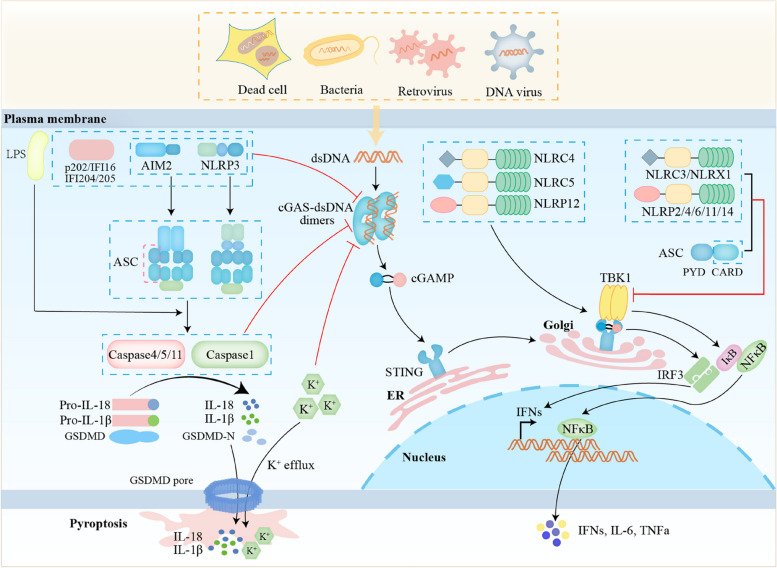 图3 炎性小体和焦亡调节cGAS-STING通路[3]
图3 炎性小体和焦亡调节cGAS-STING通路[3]
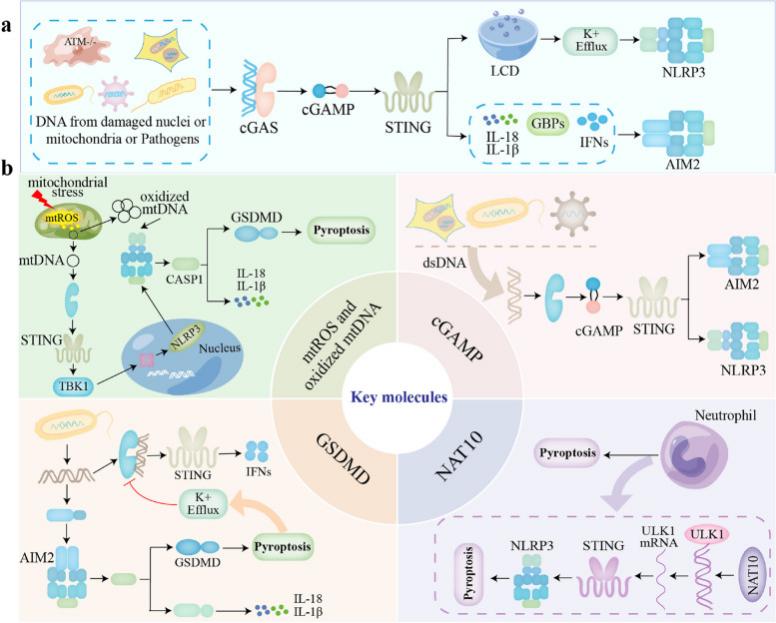 图4 cGAS-STING通路调节炎性小体和焦亡[3]
图4 cGAS-STING通路调节炎性小体和焦亡[3]
参考文献:
[1] Medzhitov R. Origin and physiological roles of inflammation. Nature. 2008 Jul 24;454(7203):428-35. doi: 10.1038/nature07201. PMID: 18650913.
[2] Decout A, Katz JD, Venkatraman S, Ablasser A. The cGAS-STING pathway as a therapeutic target in inflammatory diseases. Nat Rev Immunol. 2021 Sep;21(9):548-569. doi: 10.1038/s41577-021-00524-z. Epub 2021 Apr 8. PMID: 33833439; PMCID: PMC8029610.
[3] Liu J, Zhou J, Luan Y, Li X, Meng X, Liao W, Tang J, Wang Z. cGAS-STING, inflammasomes and pyroptosis: an overview of crosstalk mechanism of activation and regulation. Cell Commun Signal. 2024 Jan 9;22(1):22. doi: 10.1186/s12964-023-01466-w. PMID: 38195584; PMCID: PMC10775518.