SERVICE
技术服务
高质量的数据和快速的周转期以支持各项药物开发、临床前研究和临床研究
概述
外泌体(Exosomes)是被脂质双层包围的细胞外囊泡(EV),携带核酸、蛋白质、脂质和代谢物,其特征是直径为40-160 nm的杯状结构。外泌体广泛存在于各种体液中,并携带重要的生物学信息。它们可以作为信号复合物直接刺激靶细胞。此外,外泌体还可以作为转移受体和功能蛋白的桥梁,或传递改变接收细胞表型的遗传信息,从而代表细胞之间信息传递系统的新模式。外泌体显著改变细胞行为,并与多种疾病的发生和发展密切相关而成为研究热点。
细胞产生和释放外泌体过程
随着细胞膜内陷,一些细胞外脂质和蛋白质被内化到细胞中,形成早期内体(EE)。早期内体进一步成熟并转化为晚期内体。在此步骤中,晚期内体中发生多个膜内陷,以包装特定分类的蛋白质、核酸和其他物质,导致形成腔内囊泡(ILV),随后成为多泡体(MVB)。大多数MVB与质膜融合并将ILV释放到细胞外部,在那里它们被称为外泌体。一小部分MVB被转运到溶酶体并与之融合进行降解(图1)。在此过程中,RAB家族蛋白、SNARE束缚蛋白和细胞骨架蛋白都参与MVB的转运、对接和融合。细胞微环境中的条件,例如Ca2+浓度、pH值和氧气浓度也与MVB的产生和分泌密切相关[1]。
(https://pubmed.ncbi.nlm.nih.gov/32029601/)
 图1 外泌体产生和释放的过程[1]
图1 外泌体产生和释放的过程[1]
外泌体分泌机制
(1)RAB GTP酶家族是外泌体产生和分泌的关键的调节蛋白。已被证明参与外泌体产生和分泌的主要RAB GTP酶是RAB7、RAB11、RAB27和RAB35。它们能够在膜转运过程的不同步骤中发挥作用,包括囊泡形成、囊泡移动和膜合,以及确保MVB运输的正确方向,参与细胞内物质的运输和定位(图2)。(https://pubmed.ncbi.nlm.nih.gov/37492712/)
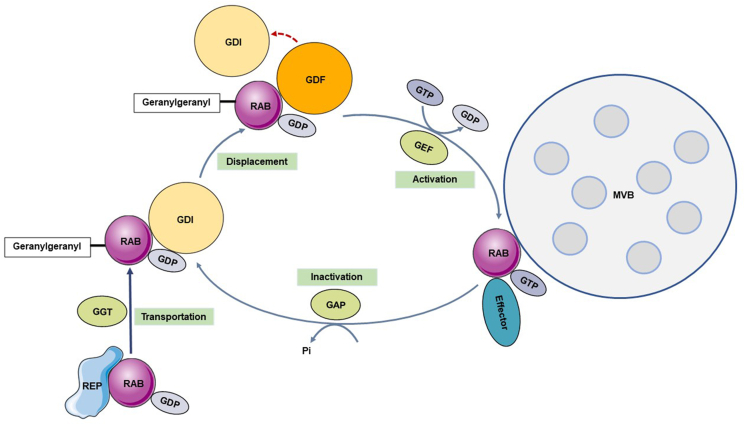 图2 RAB动态循环[2]
图2 RAB动态循环[2]
(2)细胞骨架蛋白驱动MVB运动和胞吐作用。细胞内囊泡的运动由细胞骨架结构(如肌动蛋白或微管)及其相关的分子马达介导,以确保囊泡运输的方向和有效性。肌动蛋白细胞骨架的关键调节因子Rho GTP酶家族蛋白,在肌动蛋白的快速重塑和收缩中起重要作用。
(3)SNARE介导分泌过程中MVB与质膜的融合。MVB与细胞膜的融合是形成外泌体关键的一步。这个过程主要依赖于SNARE蛋白家族,SNARE蛋白包括位于囊泡膜上的SNAP受体蛋白(囊泡SNARE、v-SNARE)和位于靶膜上的SNAP受体蛋白(靶SNARE、t-SNARE)。这些介导转运囊泡膜与靶膜的特异性识别和融合。v-SNARE确定运输方向,并特异性识别t-SNARE并与之相互作用,形成复合物,使囊泡可以附着在细胞膜上,从而保证囊泡运输的准确性(图3)[2]。
 图3 SNARE介导MVB与细胞膜融合[2]
图3 SNARE介导MVB与细胞膜融合[2]
外泌体的致病性
人类疾病的发生和发展外泌体发挥重要的作用。不同细胞来源的具有特异性生物活性成分的外泌体通过体液循环扩散到全身,并被靶细胞吸收以产生细胞间串扰,从而产生不同的生物效应。
外泌体具有两种致病模式。首先是外泌体分泌的增加增强了致病性或刺激性。例如,HIV辅助蛋白阴性因子(Nef)刺激后,HIV感染细胞中外泌体的释放增加,该因子利用这些外泌体靶向CD4 T细胞,导致其凋亡并最终引发体内免疫缺陷。此外,当溶酶体功能障碍发生时,神经元和神经胶质细胞中富含α-突触核蛋白的MVB不能通过正常的溶酶体途径降解。相反,它们通过分泌外泌体扩散到附近的神经元,导致帕金森病(PD)的神经退行性疾病。已知肿瘤细胞比任何其他细胞类型具有更高的外泌体分泌能力。来自肿瘤细胞的外泌体含有大量有利于肿瘤发展的生物活性因子。在与合适的靶细胞相互作用时,它们可以产生促血管生成、促侵袭和转移,和促免疫抑制,从而增加恶性的可能性。
外泌体的第二种致病方式是分泌减少会削弱保护性生物活性物质向健康细胞的输送。CD8 T调节(Treg)细胞在生理条件下积极发挥免疫抑制功能。当CD8 Treg细胞的外泌体分泌在病理条件下被阻断时,通过外泌体内吞途径分泌出细胞的NADPH氧化酶2(NOX2)在细胞间隔室被阻断。因此,CD8 Treg细胞失去了抑制周围CD4 T细胞活化的能力。因此,它们不能有效防御CD4 T细胞对主动脉和大传导动脉的炎症攻击,导致自身免疫性巨细胞动脉炎(GCA)。
参考文献:
[1] Kalluri R, LeBleu VS. The biology, function, and biomedical applications of exosomes. Science. 2020 Feb 7;367(6478):eaau6977. doi: 10.1126/science.aau6977. PMID: 32029601; PMCID: PMC7717626.
[2] Xu M, Ji J, Jin D, Wu Y, Wu T, Lin R, Zhu S, Jiang F, Ji Y, Bao B, Li M, Xu W, Xiao M. The biogenesis and secretion of exosomes and multivesicular bodies (MVBs): Intercellular shuttles and implications in human diseases. Genes Dis. 2022 Apr 22;10(5):1894-1907. doi: 10.1016/j.gendis.2022.03.021. PMID: 37492712; PMCID: PMC10363595.