CUSTOMER
客户中心
助力生命健康领域从基础研究到产业化的加速转化
01 小动物活体成像技术
小动物活体成像技术是一种利用多种影像学手段,在不伤害动物的前提下,对其体内生物过程进行动态、定性与定量研究的技术。通过探测组织穿透光或其他信号(如核素、磁共振、X射线或超声波)并进行图像重建,该技术可在组织、细胞乃至分子水平上反映生物学变化。常用于皮下、原位及转移瘤等肿瘤模型的研究,广泛应用于肿瘤、生物治疗及药效学等前沿领域。主要成像方式包括可见光成像、核素成像、MRI、CT和超声成像等。

图1 常见的小动物活体成像技术
体内可见光成像主要包括生物发光成像和荧光成像两种方式。生物发光成像通常通过将荧光素酶(如萤火虫荧光素酶)基因整合至目标DNA,使细胞表达相应的酶蛋白,该酶在与其底物荧光素(luciferin)发生特异性生化反应后,可在体内释放出可检测的光信号。
而荧光成像则借助绿色荧光蛋白(GFP)、红色荧光蛋白(RFP)等荧光报告基因,或利用荧光染料如FITC、Cy5、Cy7及量子点(quantum dots,QD)进行标记,通过外部激发光激发标记物后采集其发射光,实现成像目的。
两种技术均可用于实时监测活体动物体内分子与细胞行为,在生命科学研究中具有重要应用价值。
02 生物发光成像实验
实验步骤
1. 用荧光素酶基因标记肿瘤细胞等。
2. 筛选阳性克隆、绘制标记物的发光梯度曲线等。
3. 选择转染率相对高且稳定的一批细胞进行体内实验。
4. 麻醉实验动物。
5. 腹腔注射底物荧光素。最佳的检测时间是在注射后10到15分钟之间。(对于不同的动物模型,发光动力学过程并不完全一致,最好先进行预实验确定何时发光信号最强)。
6. 将麻醉动物放入成像设备中(如IVIS成像系统)。设置曝光时间、视野、binning、滤光片等参数。捕获图像,一般可连续拍摄以选取最佳时点。
7. 使用成像系统自带软件(如Living Image)分析图像。绘制感兴趣区域(ROI),获取信号强度(单位为photons/sec)。可进行时间序列、组间比较或疗效评估。
8. 数据记录与归档。记录图像、定量数据、动物编号、注射时间等实验细节。
成像结果
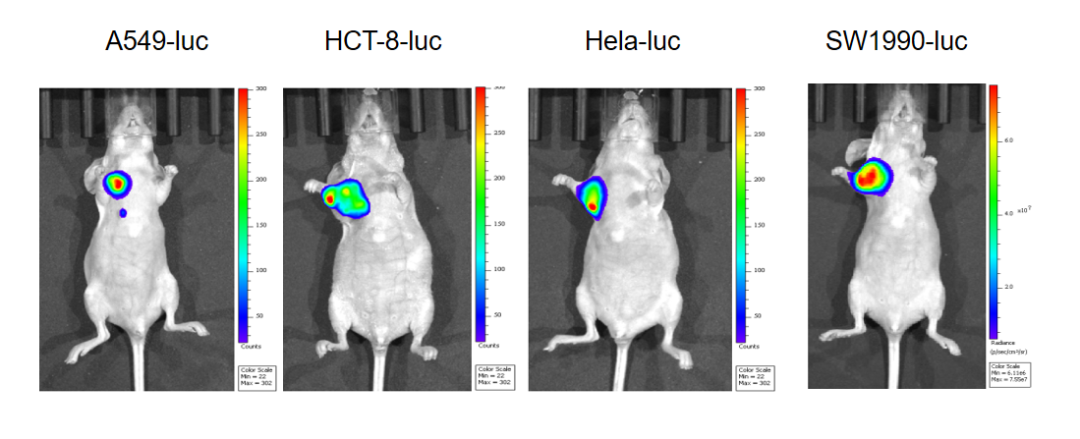
图2 皮下成瘤模型
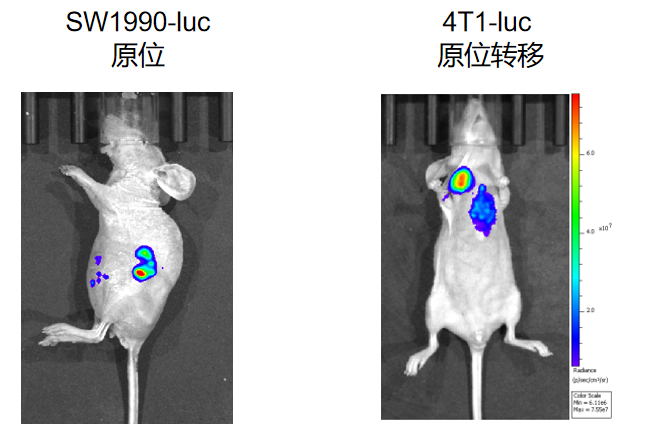
图3 原位瘤模型
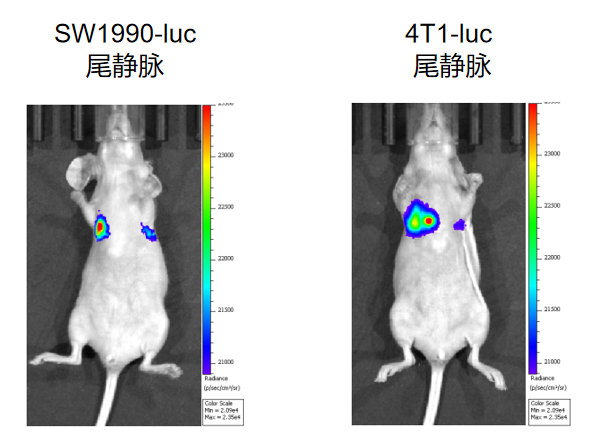
图4 尾静脉注射转移瘤模型
注意事项
1. 荧光素注射后成像时间要统一,以保证实验可比性。
2. 动物体温维持稳定,否则会影响酶反应效率。
3. 每组建议设置空白对照(未转染或未注射底物的小鼠)。
4. 若信号微弱,可延长曝光时间或提高binning。
03 荧光成像实验
实验步骤
1. 检查成像系统(如IVIS Spectrum、Bruker In-Vivo Xtreme)是否正常运行。准备荧光成像所需的探针或标记细胞(如GFP标记细胞,或FITC/Cy5/Cy7等探针)。设置实验分组、动物编号与记录表。
2. 皮下或原位接种荧光标记细胞静脉注射荧光探针或靶向分子探针,腹腔注射、尾静脉注射等多种途径均可使用。
3. 根据说明书配制探针溶液,注意遮光保存。注射方式通常为尾静脉注射或腹腔注射,剂量和注射体积根据探针种类而定。给药后等待合适时间(如1~24小时),使探针在体内靶向结合并清除非特异性背景。
4. 使用异氟烷麻醉系统或腹腔注射麻醉剂麻醉动物。
5. 将动物置于成像仪平台上,调整体位。设置激发光波长和发射光滤光片(根据探针选择,如GFP用Ex 465-495 nm / Em 510-550 nm)。调整曝光时间、binning(图像分辨率)和视野大小(FOV)。捕捉图像,确保信号强度适中不过曝,必要时可试拍几张优化参数。
6. 图像分析使用配套软件(如Living Image、Bruker MI等)打开图像。选择兴趣区域(ROI)进行定量分析(单位一般为辐照强度或总荧光强度)。进行背景扣除、图像比较、数据统计等处理。
7. 保存原始图像、ROI数据及分析报告。记录每只动物的注射时间、成像时间、参数设置等关键信息。
成像结果

图5 脾脏包膜肝转移模型
注意事项
1. 使用荧光探针时避免强光直射,操作中应遮光。
2. 多种荧光成分(如GFP与Cy5)共用时要注意通道串扰,可采用多通道成像或顺序拍摄。
3. 选择合适的滤光片组合避免背景自发荧光干扰。
4. 某些组织(如皮肤、毛发)易引起光散射或背景偏高,必要时可脱毛或调整ROI范围。
声明:本文使用图片来源于网络和文献,如有侵权请联系删除。