CUSTOMER
客户中心
助力生命健康领域从基础研究到产业化的加速转化

From: Nature Metabolism,IF=18.9
Abstract
Macrophages stimulated by lipopolysaccharide (LPS) generate mitochondria-derived reactive oxygen species (mtROS) that act as antimicrobial agents and redox signals; however, the mechanism of LPS-induced mitochondrial superoxide generation is unknown. Here we show that LPS-stimulated bone-marrow-derived macrophages produce superoxide by reverse electron transport (RET) at complex I of the electron transport chain. Using chemical biology and genetic approaches, we demonstrate that superoxide production is driven by LPS-induced metabolic reprogramming, which increases the proton motive force (∆p), primarily as elevated mitochondrial membrane potential (Δψm) and maintains a reduced CoQ pool. The key metabolic changes are repurposing of ATP production from oxidative phosphorylation to glycolysis, which reduces reliance on F1FO-ATP synthase activity resulting in a higher ∆p, while oxidation of succinate sustains a reduced CoQ pool. Furthermore, the production of mtROS by RET regulates IL-1β release during NLRP3 inflammasome activation. Thus, we demonstrate that ROS generated by RET is an important mitochondria-derived signal that regulates macrophage cytokine production.
摘要
由脂多糖(LPS)刺激的巨噬细胞会产生线粒体来源的活性氧(mtROS),它们作为抗菌剂和氧化还原信号发挥作用;然而,LPS诱导线粒体超氧阴离子生成的机制尚不清楚。在此,我们表明,由骨髓来源的巨噬细胞在LPS刺激下通过电子传递链复合体I的逆向电子传递(RET)产生超氧阴离子。通过化学生物学和遗传学方法,我们证明超氧阴离子的产生是由LPS诱导的代谢重编程驱动的,这种重编程增加了质子动力(Δp),主要表现为线粒体膜电位(Δψm)的升高,并维持了一个还原型辅酶Q(CoQ)池。关键的代谢变化是将ATP的产生从氧化磷酸化重新分配到糖酵解,这减少了对F1FO-ATP合酶活性的依赖,从而导致更高的Δp,而琥珀酸的氧化则维持了一个还原型CoQ池。此外,通过RET产生的mtROS调节了NLRP3炎症体激活过程中白细胞介素-1β(IL-1β)的释放。因此,我们证明了通过RET产生的ROS是一种重要的线粒体来源的信号,调节巨噬细胞细胞因子的产生。
巨噬细胞是先天免疫系统的关键组成部分,它们通过产生活性氧(ROS)来对抗细菌感染。线粒体是超氧阴离子和过氧化氢的主要生成场所,这些活性氧不仅具有杀菌作用,还参与调节巨噬细胞的细胞因子产生。尽管线粒体来源的ROS(mtROS)在巨噬细胞免疫功能中很重要,但其产生的具体机制尚不清楚。
内容总结
研究方法
细胞培养和刺激:研究者使用小鼠骨髓来源的巨噬细胞(BMDMs),并在LPS刺激下观察其反应。
代谢分析:通过Seahorse XF技术测量线粒体呼吸和细胞外酸化率,以及通过质谱分析代谢物的变化。
基因敲除小鼠模型:使用ND6P25L基因敲除小鼠模型,该模型无法通过RET产生mtROS,以研究mtROS在细胞因子调节中的作用。
免疫印迹和ELISA:用于检测蛋白质表达和细胞因子释放。
活细胞共聚焦显微镜:用于观察线粒体形态变化和mtROS的产生。
实验结果
LPS诱导的代谢重编程:LPS刺激导致BMDMs的代谢重编程,从氧化磷酸化转向糖酵解以产生ATP,并伴随着琥珀酸的积累。这种代谢变化导致质子动力(Δp)增加,主要表现为线粒体膜电位(Δψm)升高,并维持一个还原型辅酶Q(CoQ)池。
线粒体形态变化:LPS刺激后,线粒体形态从点状变为丝状,表明线粒体融合增加。
mtROS的产生:使用MitoNeoD探针,研究者发现LPS刺激的BMDMs产生超氧阴离子,且这种产生依赖于RET。通过化学和遗传学方法,研究者证明了超氧阴离子的产生是由LPS诱导的代谢重编程驱动的。
CoQ池的还原状态:尽管LPS处理后CoQ池的还原状态没有显著变化,但维持CoQ池的还原状态对于超氧阴离子的产生至关重要。
琥珀酸氧化的作用:通过抑制琥珀酸脱氢酶(SDH),研究者发现琥珀酸氧化对于维持CoQ池的还原状态和Δψm的升高是必要的,从而推动超氧阴离子的产生。
RET在复合体I中的作用:使用ND6P25L小鼠模型,研究者证明了LPS激活的巨噬细胞通过复合体I的RET产生超氧阴离子,这一过程由Δψm的升高和CoQ池的还原状态维持。
mtROS对细胞因子产生的调节:尽管mtROS的产生与细胞因子的产生时间上一致,但研究发现mtROS并不显著调节LPS诱导的细胞因子产生。然而,mtROS在NLRP3炎症体激活过程中调节IL-1β的释放。
NLRP3炎症体激活:研究者发现,mtROS通过RET调节IL-1β的释放,这一过程涉及GSDMD的氧化和孔形成,导致细胞焦亡和IL-1β的成熟释放。
关键结论
LPS刺激通过代谢重编程增加Δψm和维持还原型CoQ池,从而通过复合体I的RET产生超氧阴离子。
mtROS的产生对于NLRP3炎症体激活过程中IL-1β的释放至关重要,但对LPS诱导的细胞因子产生影响较小。
通过遗传模型(ND6P25L小鼠)的研究,研究者能够区分mtROS和代谢物(如琥珀酸)在调节巨噬细胞细胞因子产生中的作用。
研究意义
这项研究不仅阐明了LPS诱导下巨噬细胞中mtROS产生的机制,还揭示了mtROS在调节炎症反应中的具体作用。这些发现对于理解巨噬细胞的免疫代谢调控具有重要意义,并可能为开发针对炎症和感染的新疗法提供理论基础。
图文摘要
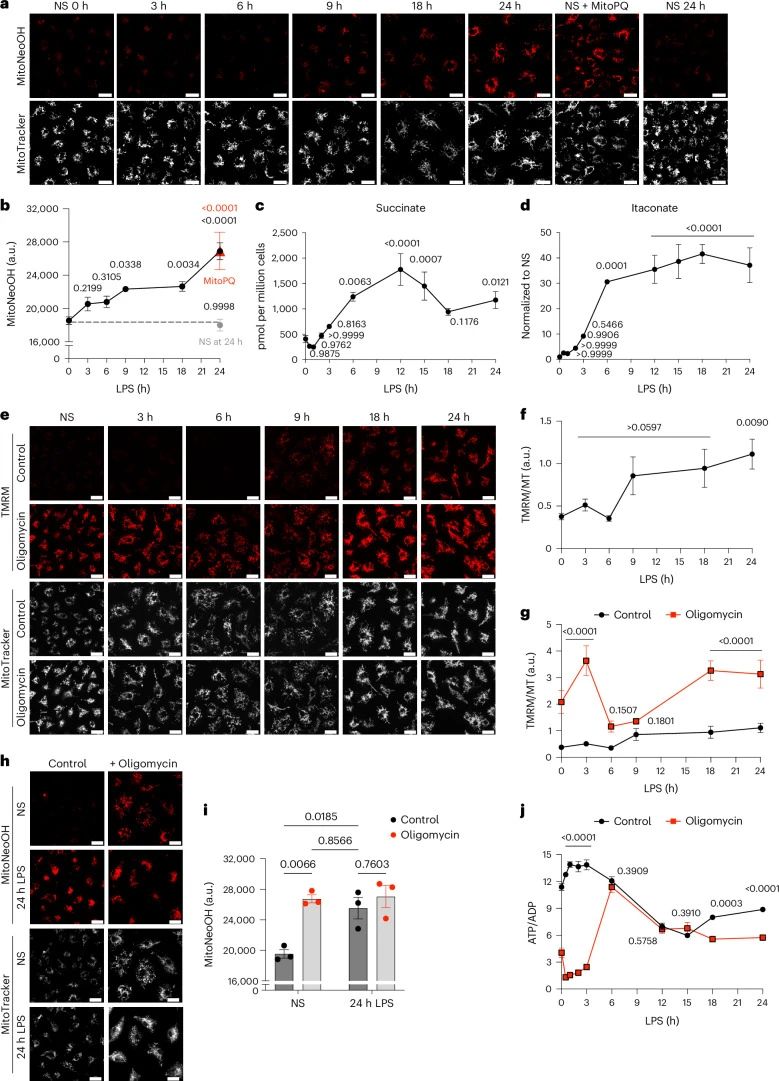
图1|原位多组学揭示了HCC中的免疫代谢重塑与空间组织结构
a. IMC(成像质谱细胞术)图像展示了不同类型细胞在肿瘤样本(患者1)中的空间分布。
b. 显微图像展示了免疫细胞在肿瘤边界的富集。
c. 不同区域(肿瘤核心、边缘、非肿瘤区)中各种细胞类型的比例比较。
d. 免疫细胞亚群在不同空间区域的富集情况。
e. MALDI成像显示了脂质分布的空间异质性。
f. 代谢物在肿瘤与非肿瘤区域中的差异表达。
g. 网络图揭示免疫与代谢因子之间的空间相关性。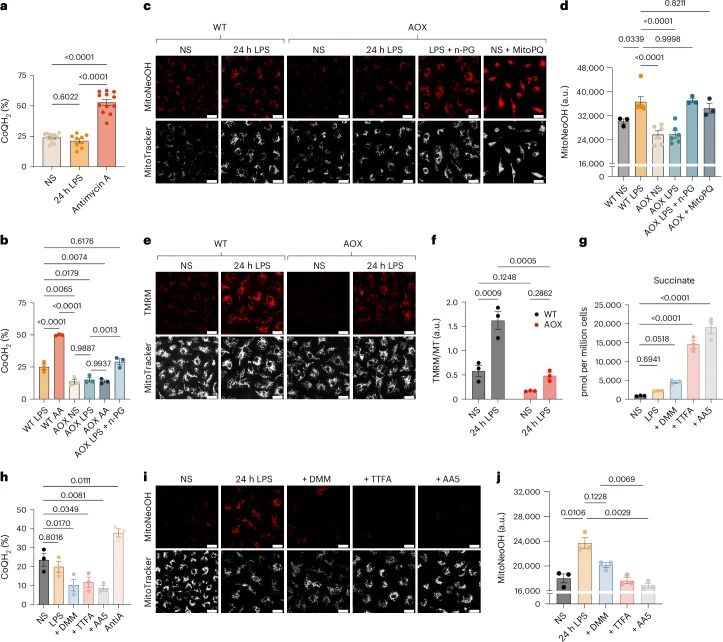
图2|T细胞在肿瘤边缘的功能状态与代谢环境密切相关
a. CD8⁺ T细胞在肿瘤边缘的空间聚集。
b. 空间转录组展示了T细胞活性和耗竭标记物的表达。
c. 代谢产物(乳酸等)在肿瘤区域中的富集。
d. T细胞耗竭与乳酸相关性的空间映射图。
e. CD8⁺ T细胞与肿瘤代谢之间的空间关系。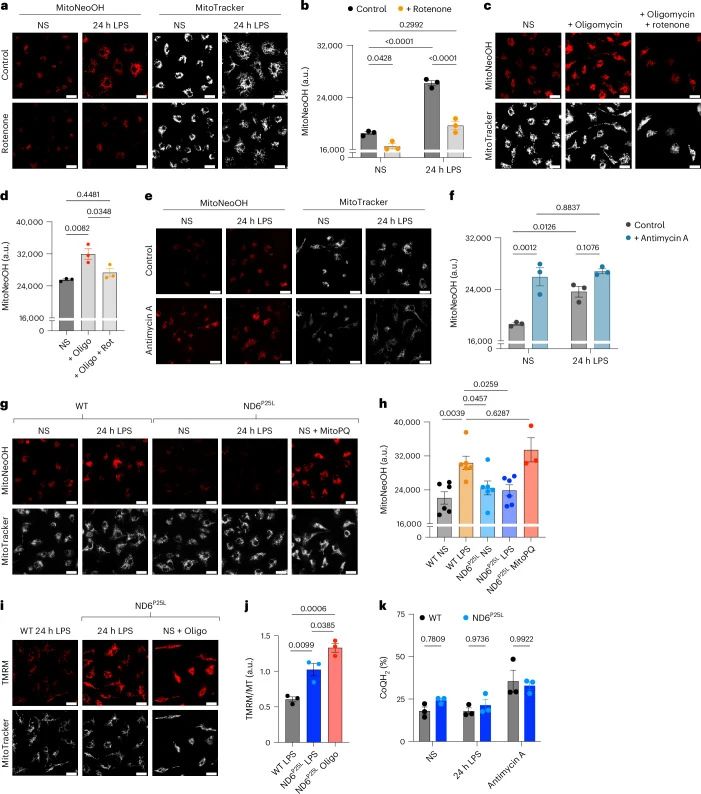
图3|树突状细胞与CD8⁺ T细胞的互作及其与乳酸代谢的耦合
a. 肿瘤边缘区域的树突状细胞聚集图。
b. CD8⁺ T细胞与树突状细胞在空间上的共定位。
c. 树突状细胞中乳酸代谢相关通路的富集分析。
d. 乳酸信号与免疫激活标志物的空间关联。
e. 模拟图示意树突状细胞在乳酸丰富环境下的状态转变。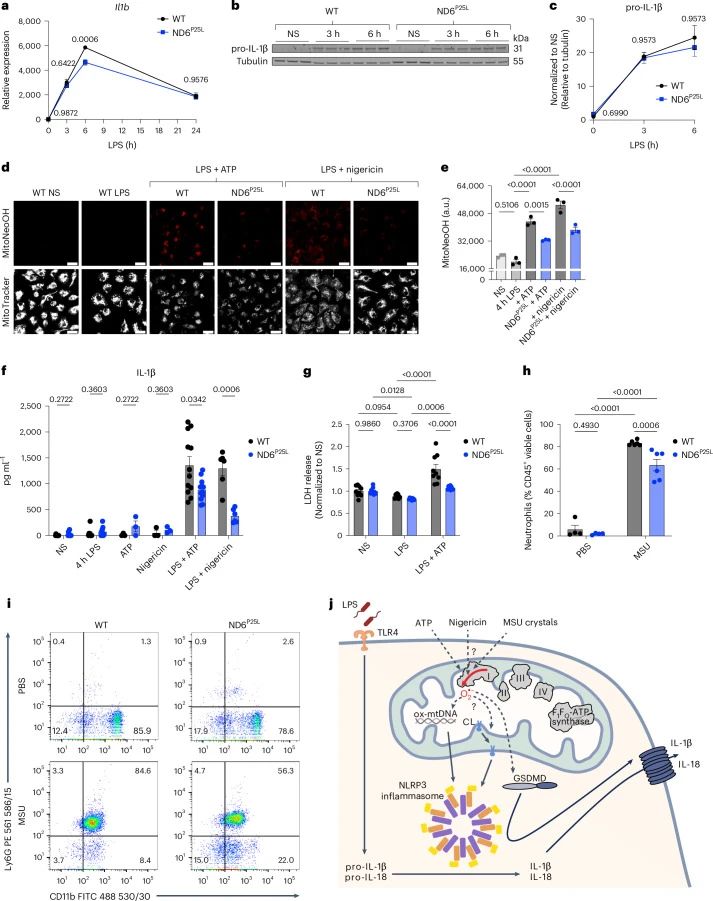
图4|基于空间分型预测HCC患者预后与免疫治疗反应
a. 三类空间代谢免疫微环境的识别(SIME I-III)。
b. 三类SIME的代谢和免疫特征对比。
c. SIME亚型与患者生存率的相关性分析。
d. SIME与T细胞功能状态的关联。
e. 空间免疫代谢特征预测免疫治疗响应情况。
参考文献:
Casey AM, Ryan DG, Prag HA, Chowdhury SR, Marques E, Turner K, Gruszczyk AV, Yang M, Wolf DM, Miljkovic JL, Valadares J, Chinnery PF, Hartley RC, Frezza C, Prudent J, Murphy MP. Pro-inflammatory macrophages produce mitochondria-derived superoxide by reverse electron transport at complex I that regulates IL-1β release during NLRP3 inflammasome activation. Nat Metab. 2025 Mar;7(3):493-507. doi: 10.1038/s42255-025-01224-x. Epub 2025 Feb 19. PMID: 39972217; PMCID: PMC11946910.