CUSTOMER
客户中心
助力生命健康领域从基础研究到产业化的加速转化
作为中国传统医学的重要组成部分,中药拥有数千年的发展历程,其理论体系与临床实践在长期积累中逐步完善与成熟。在恶性肿瘤的防治方面,中医药已成为传统医学体系中的重要分支。依据“整体观”及“辨证施治”等核心理念,中医认为肝细胞癌(HCC)的发生涉及正气不足、外邪侵袭以及气血运行障碍等多种内外因素的综合作用。通过个体化的辨证论治方式,中医采取系统化手段来进行HCC的综合管理,制定可调节肿瘤微环境(TME)、抑制肿瘤扩展、改善生活质量的差异化治疗策略。
当前中医治疗HCC的方法涵盖单味药材、有效活性提取物、传统复方、标准化中成药以及针灸等多种形式。相比于常规的抗癌治疗手段,中药具有良好的可及性、较少的毒副反应以及稳定的临床疗效,因而成为整合肿瘤学研究中的关键组成部分。特别是在联合治疗中,如联合免疫检查点抑制、靶向药物或放化疗等,中药展现出显著的协同增效与减毒作用。研究表明,中医干预不仅可有效抑制肿瘤增殖与转移,还可逆转耐药性,并缓解靶向治疗或放化疗带来的毒副反应,从而显著提升患者的生存质量与治疗依从性。
近年来,分子机制研究进一步揭示,中药可通过多成分、多靶点的复合作用方式动态调节TME,影响免疫逃逸、血管生成及炎症反应等关键生物过程。本综述系统梳理了HCC肿瘤微环境的异质性特点及其在病理进展中的作用机制,深入分析了中药在调控TME中的分子干预机制,并归纳出一系列具有潜在治疗价值的中药活性成分。同时,文章探讨了中医药与现代治疗手段的整合路径,提出了多层次协同的治疗网络,为构建更精准、高效的HCC综合干预模式提供了理论基础与转化依据。
2025年6月10日,上海中医药大学交叉科学研究院张辉教授团队联合岳阳中西医结合医院闫秀丽教授,在《Molecular Cancer》(IF=27.7)上发表题为 “The tumor microenvironment in hepatocellular carcinoma: mechanistic insights and therapeutic potential of traditional Chinese medicine” 的综述论文。该文全面解析了HCC肿瘤微环境中细胞组分(如癌相关成纤维细胞、肿瘤相关巨噬细胞、肿瘤浸润淋巴细胞)与非细胞组分(如细胞外基质、细胞因子)之间的动态交互网络,重点阐述了中药通过免疫调节(PD-1/PD-L1轴)、基质改建(MMPs/TIMPs平衡)及抗血管生成(VEGF通路等)等机制实现多靶点联合干预,为HCC的联合治疗策略拓展了新的研究方向与临床思路。

01
摘要
肝细胞癌(HCC)的进展和治疗抵抗受到肿瘤微环境(TME)的动态相互作用的深刻影响。HCC TME包括一个复杂的细胞成分网络,包括癌症相关成纤维细胞、肿瘤相关巨噬细胞和浸润的免疫细胞,以及细胞外基质蛋白、细胞因子和血管生成介质等非细胞因子。这些成分共同促进免疫逃逸、基质重塑和新生血管形成,驱动肿瘤侵袭性和治疗抵抗。越来越多的证据表明,中医药可能通过多模式机制,如免疫调节来增强抗肿瘤免疫和减少调节性细胞群,基质正常化来减少成纤维细胞活化和病理性基质沉积,以及抗血管生成作用来限制肿瘤血管化,为重编程具有免疫抑制作用的HCC TME提供了一种有前景的策略。值得注意的是,与传统疗法(包括免疫检查点抑制剂、酪氨酸激酶抑制剂和细胞毒性方案)联合使用时,中药复方显示出协同作用的潜力,可能在提高疗效的同时减轻不良反应。然而,关键挑战仍然存在,如肿瘤内异质性、草药制剂的药代动力学变异性,以及需要严格的临床前-临床转化。未来的研究应优先考虑利用组学技术从系统层面剖析中药介导的TME调控,以机制研究为指导合理设计基于中药的联合治疗,以及规范可临床转化的中药治疗方案。本综述综合了目前对tme驱动的HCC发病机制的理解,并强调了中医药作为一种补充模式的新兴范式,以重新校准肿瘤-免疫-间质轴,以提高治疗效果。
肿瘤微环境(TME)在影响肿瘤生长、转移和治疗反应方面起着至关重要的作用。各种细胞和非细胞成分之间的相互作用为癌细胞创造了一个支持性的生态位,促进其生存、增殖和扩散。 这些成分可以根据相互作用的性质和亲肿瘤信号与抗肿瘤信号的平衡,既可以促进也可以抑制肿瘤进展。
肝癌微环境受多种因素的影响,每个因素都有助于肝癌细胞的支持性生态位的创建,从而促进肿瘤的发生、发展和转移。肝癌微环境概况如图1所示。
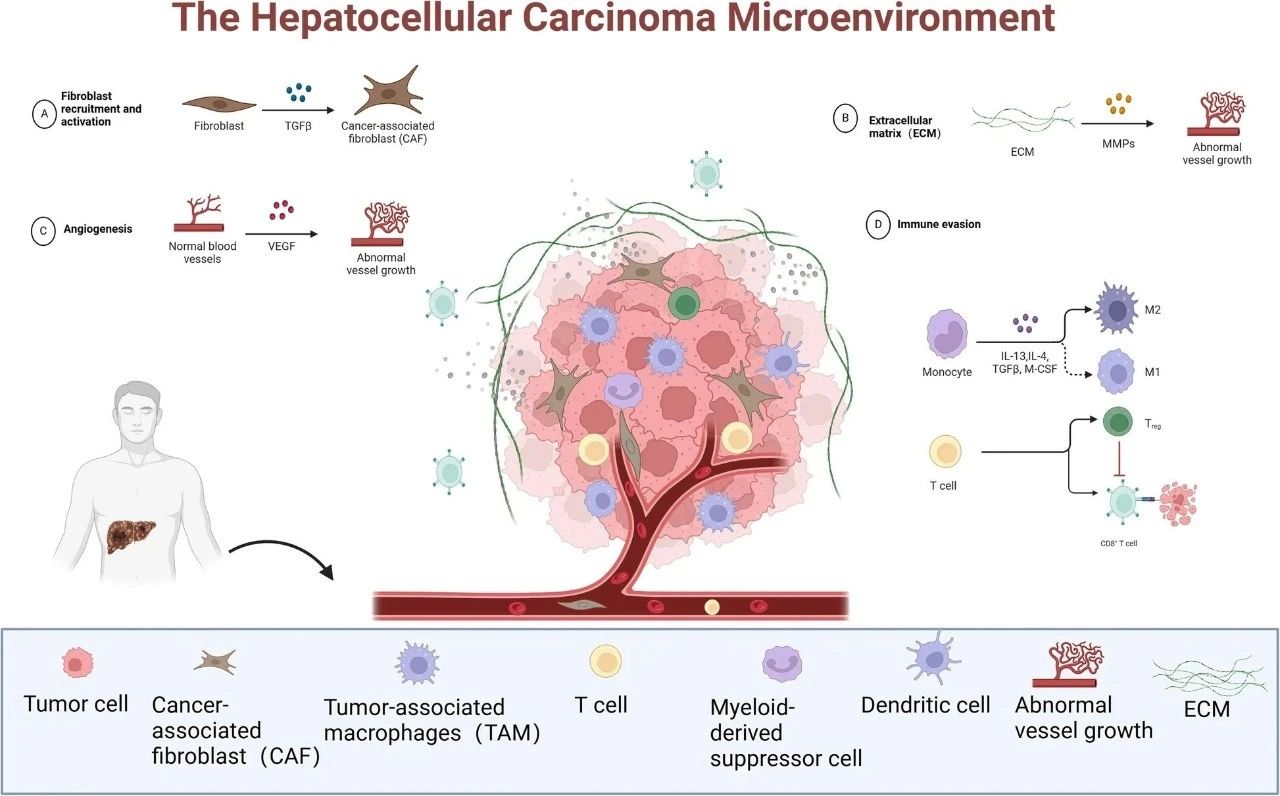
图1 肝细胞癌微环境概述
02
中药调控肝癌微环境的机制
肝细胞癌(HCC)的分子病理机制异常复杂,受到肿瘤微环境(TME)内部多种因素交互作用的深刻影响。在这一背景下,中医药(Traditional Chinese Medicine, TCM)凭借其多靶点、多层次以及系统性干预等特点,逐渐展现出作为治疗手段的潜力。TCM以整体观为指导,能够系统性地调节TME中的多个环节,这对于提高HCC治疗效果具有重要意义。研究表明,中医通过多通路、多途径的综合作用,能够重塑肿瘤生存环境,使其变得不利于癌细胞的生长与扩散,同时增强肿瘤对治疗手段的敏感性。这种治疗理念与HCC发病的多因素机制高度契合,为探索更为高效的新型干预策略提供了可行方向(参见图2)。
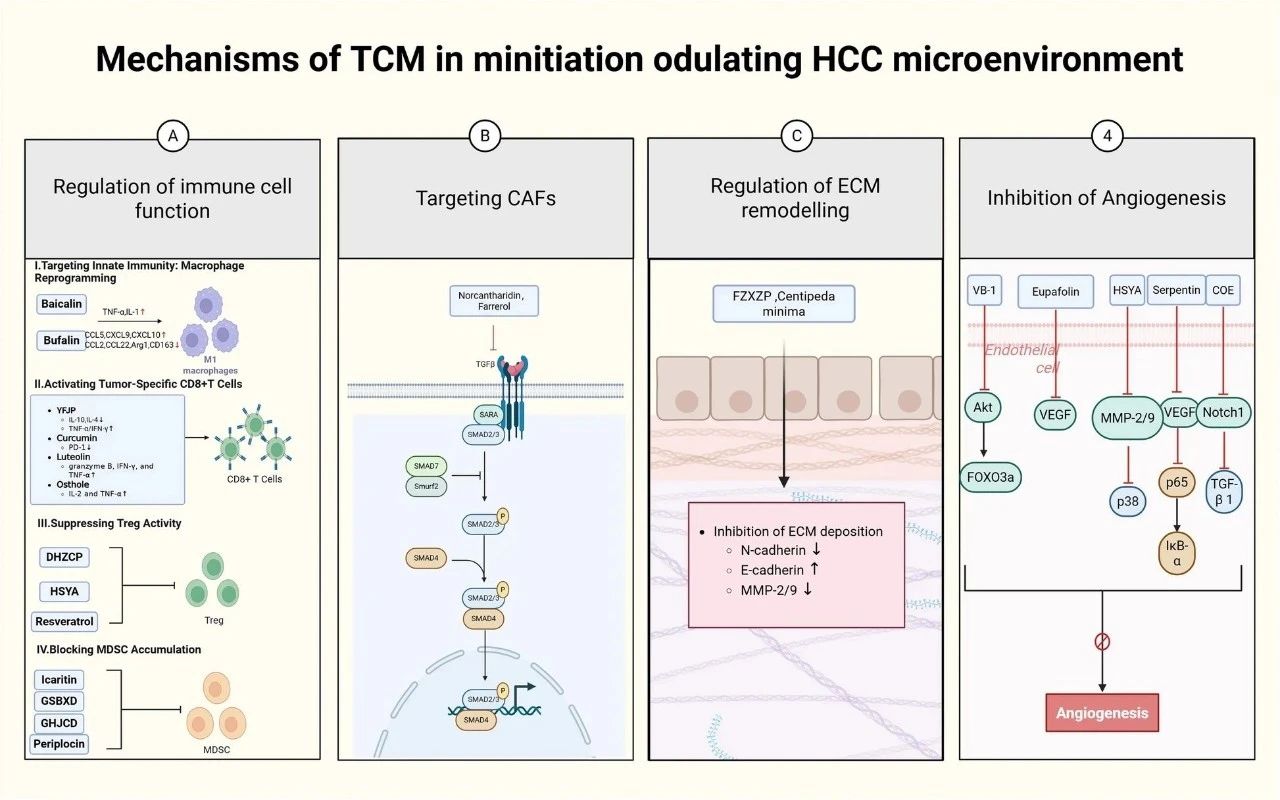
图2 中药调控肝癌微环境的机制
A. 在TME中,中药可通过调节免疫细胞功能促进抗肝癌治疗。
B. 中药可通过靶向作用于CAFs,抑制其促肿瘤功能,逆转TME中免疫抑制状态。
C. 中药通过调节细胞外基质的重塑,抑制肝癌的转移。
D. 中药通过抑制血管生成,抑制肝癌的生长和转移
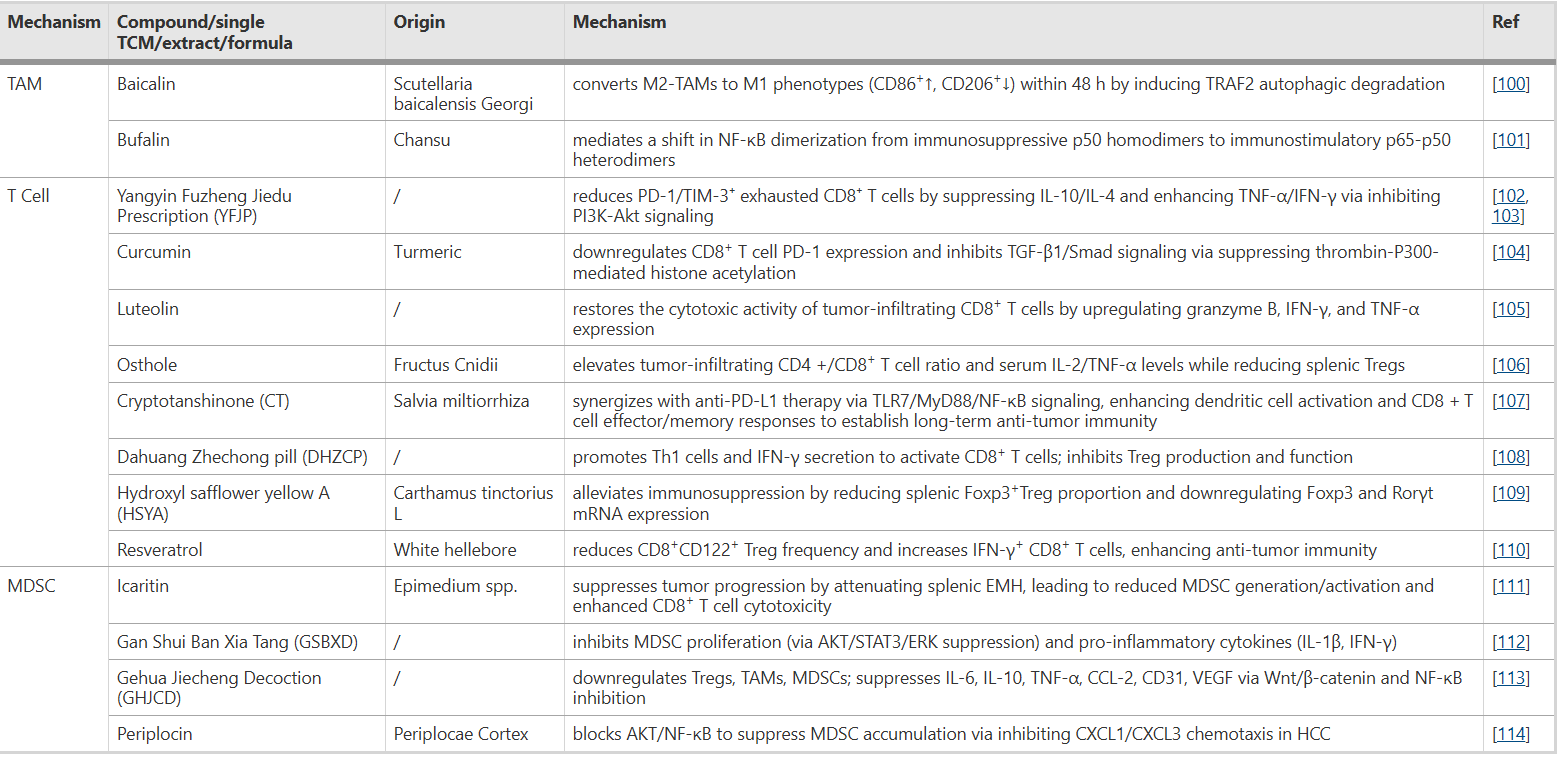
表1 中药调节免疫细胞功能
03
具有调节肝癌微环境潜力的草药
单味中药及其活性成分
黄连素
黄连素(Berberine, BBR)作为黄连中的主要活性成分之一,在调控肝细胞癌(HCC)肿瘤微环境方面展现出广泛而多层次的生物学效应。已有研究表明,BBR可在剂量依赖的条件下显著抑制HCC小鼠模型中的肿瘤生长,其潜在机制主要通过对免疫微环境的深度干预实现。一方面,BBR能够诱导巨噬细胞极化向M1表型转变,增强其抗肿瘤免疫功能;另一方面,在与NK92-MI细胞共作用的条件下,BBR可提升自然杀伤细胞(NK cells)对SMMC-7721和Hep3B肝癌细胞的杀伤能力,具体表现为穿孔素与颗粒酶B表达的上调,从而有效诱导肿瘤细胞的程序性死亡。此外,BBR还被证实可通过抑制PI3K/AKT/mTOR信号通路的激活,并调控细胞外基质(ECM)相关因子,抑制HCC细胞的侵袭与转移潜能。值得注意的是,当BBR与索拉非尼联合应用时,可显著逆转部分耐药性,进一步增强治疗效果。
鉴于BBR在体内的生物利用度较低,近年来发展出的纳米递送系统(如BBR负载型纳米粒,BBR-NPs)有效提高了其在肝组织中的靶向性,并在黄曲霉毒素B1(AFB1)诱导的HCC动物模型中展现出更强的抗肿瘤活性。然而,将BBR推向临床仍存在若干挑战。例如,其多靶点作用机制尚需借助单细胞测序等技术手段进一步解析,以识别对BBR高度敏感的患者亚群(如SH3D21高表达者);此外,围绕表观遗传标记物(如5-甲基胞嘧啶,5mC)建立个体化治疗策略亦是未来的重要方向。后续研究还应深入探讨BBR对肿瘤相关成纤维细胞(CAFs)和外泌体的调控效应,并通过化学结构改造优化其药代动力学性能,从而加快其由实验室研究向临床转化的进程。
华蟾酥毒基
华蟾酥是一种来源于蟾蜍皮肤腺体分泌物的干燥中药制剂,历来在中医药系统中被广泛应用于肿瘤治疗。该药物含有21种主要活性成分,包括蟾酥配体衍生物如Bufalin和Cinobufagin,具备多靶点、多通路的药理特性,可对肝细胞癌(HCC)的肿瘤微环境产生广泛调控。实验数据表明,华蟾酥在剂量和时间依赖的条件下能够有效抑制HCC细胞的增殖活性;在由二乙基亚硝胺(DEN)诱导的HCC大鼠模型中,其使用显著降低了肿瘤体积,并诱导肿瘤细胞发生凋亡反应。
此外,研究进一步揭示,Cinobufacini通过抑制c-Met/ERK信号轴活性,能够有效干预上皮-间质转化(EMT)过程,从而显著降低HepG2肝癌细胞的迁移和侵袭能力。这些发现为华蟾酥及其衍生成分在HCC治疗中的应用提供了理论支持,也为靶向肿瘤微环境的中药干预策略拓展了新的研究路径。
黄芩
黄芩(Scutellaria baicalensis Georgi)及其所含的黄酮类活性成分,如黄芩素和黄芩苷,在调控肝细胞癌(HCC)肿瘤微环境方面展现出多维度、系统性的抗肿瘤潜能。研究显示,黄芩素可诱导HCC细胞发生免疫原性细胞死亡(ICD),并进一步激活机体的适应性免疫系统,从而有效逆转原本处于免疫抑制状态的肿瘤微环境。同时,黄芩素还通过抑制乳酸脱氢酶A(LDHA)的酶活,降低肿瘤微环境中乳酸积聚,缓解酸性环境对T淋巴细胞功能的抑制,提升免疫反应的效率。
网络药理学研究进一步指出,黄芩素可通过调控AKR1B10/PI3K-Akt信号通路,显著抑制HCC细胞的侵袭性行为,揭示其在分子靶点层面的调控机制。在临床实践中,黄芩复方制剂(如黄芩清泻汤,HQZX汤)常与经导管动脉化疗栓塞术(TACE)联合应用于中晚期HCC患者治疗中,结果显示其可有效延长中位无进展生存期(PFS)。代谢组学分析亦发现黄芩地上部,如茎与叶,富含具有生物活性的野生黄芩苷类成分,提示其在资源开发与药物创新方面的广阔前景。
然而,黄芩作用的多靶点特性也带来一定挑战,其直接调控的分子靶标(例如免疫检查点通路)尚未完全明晰;目前可获得的临床数据主要源自样本量较小的观察性研究,缺乏大规模证据支持。未来研究应结合空间转录组学技术,探索黄芩成分在时间与空间维度上对肿瘤微环境异质性的影响机制;同时,有必要开发黄芩苷的纳米晶型药物载体,以提升其生物利用度和组织靶向性,并开展多中心、随机对照的三期临床试验,验证其与PD-1免疫检查点抑制剂的潜在协同效应,从而加速该传统药物在现代精准医学体系中的临床转化。
中药复方
小柴胡汤
小柴胡汤(Xiaochaihu Decoction, XCHT)作为传统中医中广泛应用的经典复方,由柴胡、黄芩、龙胆草等多种中药组成,具有多组分、多靶点的协同作用机制。近年来的研究逐渐揭示出其在调控肝细胞癌(HCC)肿瘤微环境方面的广泛潜能,涵盖了免疫调节、炎症控制与抗纤维化等多个维度。实验结果显示,XCHT通过自乳化纳米递送系统实现靶向定位于肝组织,在四氯化碳(CCl₄)诱导的肝纤维化向HCC进展的小鼠模型中,显著降低血清中丙氨酸转氨酶(ALT)水平;同时通过抑制促炎因子如TNF-α和IL-6的分泌,有效减轻慢性炎症反应,并减少肝组织中的胶原沉积,从而缓解纤维化进程。
在抗肿瘤作用方面,XCHT中的主要活性成分,如柴胡皂苷和黄芩素,被证实可通过下调基质金属蛋白酶-9(MMP-9)的表达,抑制由血管内皮生长因子(VEGF)介导的新生血管形成,从而限制HCC细胞的侵袭与远端转移能力。进一步的研究还表明,XCHT与索拉非尼联合应用具有协同抗癌效应,可明显增强对肿瘤细胞活力的抑制作用。这些发现不仅凸显了XCHT在中晚期HCC干预中的治疗潜能,也为其现代药物递送形式和联合治疗策略提供了理论依据与实践路径。
扶正解毒汤
扶正解毒汤作为一种传统中药复方,通过多层面调控肝细胞癌(HCC)肿瘤微环境,展现出系统性的抗肿瘤作用潜力。研究证据表明,在缺氧诱导的微环境中,该方剂能够通过抑制Wnt/β-catenin信号通路,显著削弱HCC肿瘤干细胞的自我更新能力,从而降低肿瘤的复发几率和远处转移风险。
在联合治疗策略中,扶正解毒汤与经导管动脉化疗栓塞术(TACE)共同应用时,不仅有效增强了化疗药物对HCC细胞的杀伤力,还通过调节PI3K/AKT信号轴,缓解了化疗过程中可能引发的肝毒性反应和骨髓抑制等副作用。在临床层面,扶正解毒汤作为术后辅助治疗药物,有助于降低肝癌患者的复发率;其抗转移机制可能与下调基质金属蛋白酶-9(MMP-9)和组织金属蛋白酶抑制因子-1(TIMP-1)表达水平密切相关。此外,与PD-1免疫检查点抑制剂联用时,该方剂也表现出协同效应,进一步抑制肿瘤转移和进展。
鳖甲煎丸
鳖甲煎丸(Biejia Jianwan,BJJW)及其优化配方(如改良型M-BJJW)在调控肝细胞癌(HCC)微环境方面展现出多维度、系统性的治疗效应,尤其在免疫调节、抗肝纤维化以及协同抗肿瘤等方面具有显著优势。动物实验结果表明,在二乙基亚硝胺(DEN)诱导的HCC大鼠模型中,M-BJJW可显著提升细胞毒性T淋巴细胞(CTLs)的比例,同时抑制调节性T细胞(Tregs)数量,并下调多种免疫抑制因子(如IL-6和IL-10)的表达水平。其主要作用机制是通过抑制HIF-1α/STAT3/NF-κB信号通路的活化,进而降低肿瘤细胞程序性死亡配体1(PD-L1)的表达,从而阻断肿瘤免疫逃逸路径。
临床方面的观察也为其应用提供支持。例如,含有龟甲类成分的中药复方,以清热解毒、化瘀养阴为主要功能,被广泛用于HCC患者术后的辅助治疗中,已显示出可降低术后复发率、延缓转移进程并延长总体生存时间的潜力。此外,研究推测M-BJJW通过抑制PD-L1表达,不仅可增强机体抗肿瘤免疫反应,还有望与PD-1/PD-L1免疫检查点抑制剂联合应用,形成更为有效的免疫治疗策略。
值得一提的是,某些复方药物(如恩替卡韦联合贝加肾安)也被证实可降低我国慢性乙型肝炎患者进展为HCC的风险,为预防性干预提供了可能路径。综上所述,鳖甲煎丸以其多通路、多靶点的综合调节机制,在HCC治疗中的应用前景广阔。然而,其临床推广仍需在标准化配方、剂量控制以及大规模随机对照临床试验等方面进一步深入,以推动其从传统经验用药向现代循证医学的有效转化。
04
将中医与常规疗法结合治疗肝癌
中医药(TCM)联合现代治疗手段在肝细胞癌(HCC)治疗中的潜力正日益受到关注。以免疫治疗为例,尽管免疫检查点抑制剂(如PD-1/PD-L1抗体)在HCC临床治疗中取得了积极进展,但其总体应答率仍相对较低,且部分患者可能出现免疫相关不良反应。研究表明,中医药可通过多靶点调节肿瘤微环境(TME),改善免疫功能,从而增强免疫治疗的疗效并减轻副反应,展现出良好的协同作用。
在靶向治疗方面,药物如索拉非尼和乐伐替尼目前作为晚期HCC的标准治疗方案已被广泛应用,但其疗效往往受限,并存在易于产生耐药的问题。中医药可通过干预TME、抑制肿瘤耐药机制、提高细胞对靶向药物的敏感性,从而与靶向治疗形成互补,提升治疗整体效果。
化疗和放疗作为HCC的重要治疗手段,在控制病情方面发挥着不可替代的作用,但其疗效有限且常伴随明显毒副作用。中医药通过增强机体耐受性、减轻化疗/放疗相关毒性,并协同抑制肿瘤进展,已被证实可提升传统治疗手段的综合疗效。
总体来看,中医药以“整体调理”和“辨证施治”为核心,强调治疗的个体化和系统性,与现代精准医学的理念高度契合。基于此,本文提出了一个中西医融合治疗HCC的整合模型(见图3),旨在通过协同优化治疗策略,实现更全面、个体化的干预路径。这种融合方式不仅为HCC患者提供了新的治疗思路,也为传统医学与现代医学的深度结合提供了可行的范式。
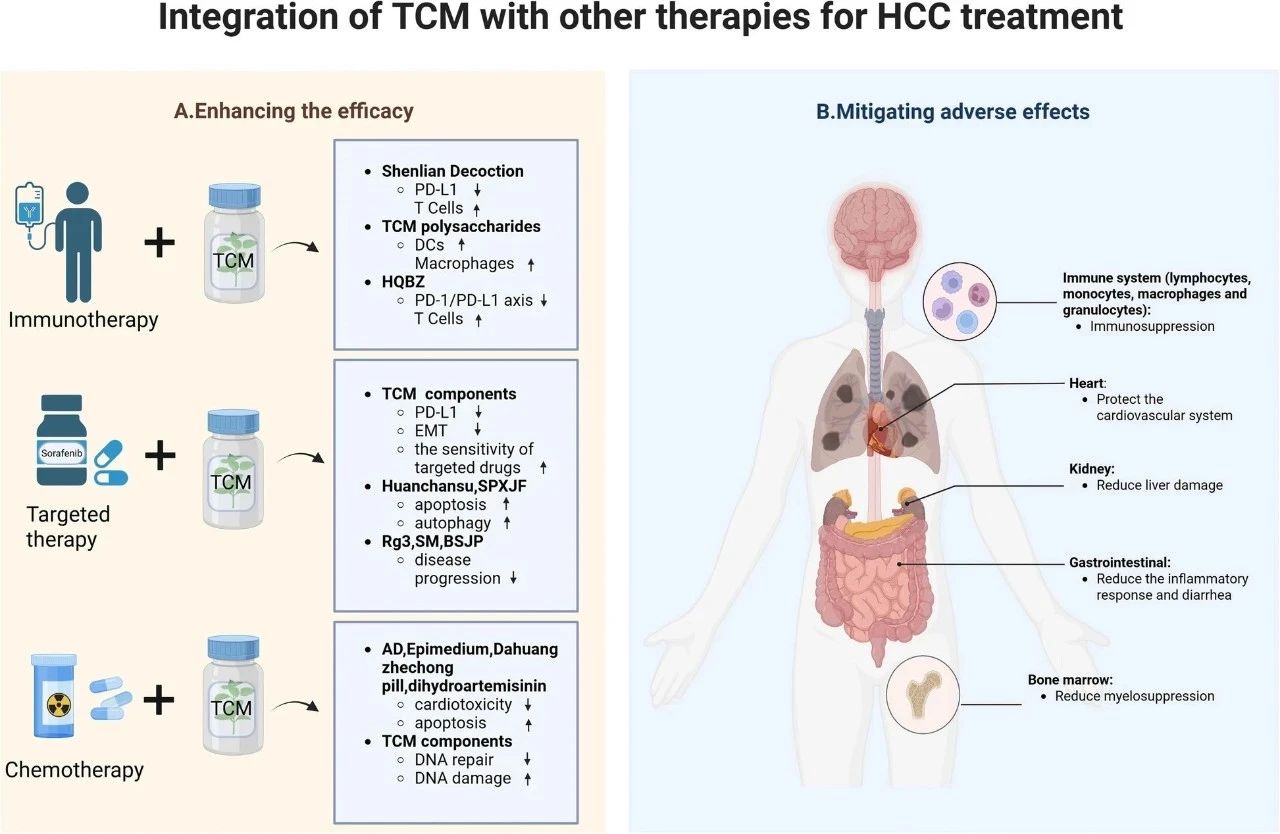
图3 提出将TCM整合到HCC治疗策略中的模型。
A. TCM与免疫治疗、靶向治疗和化疗联合使用可以提高药物的疗效。
B. TCM与免疫治疗、靶向治疗和化疗联合使用可以减轻西药的副作用。
05
挑战与未来展望
在研究HCC的微环境中的限制和障碍
肝细胞癌(HCC)的肿瘤微环境(TME)结构极为复杂,这种多层次的复杂性为其深入研究带来了显著挑战。TME不仅包含多种类型的细胞成分,如肝星状细胞、免疫细胞、肝窦内皮细胞等,这些细胞之间存在密切的相互作用和信号交流。这种细胞间串扰可促进HCC的发生发展,包括肿瘤细胞的增殖、转移、免疫逃逸和血管新生等过程。目前,许多研究仍然集中于在理想化的实验环境中,探讨特定信号通路和分子机制在HCC恶性进展中的作用,通常采用单一刺激因素和单一研究目标的实验设计。然而,真实的肿瘤微环境远比这更为复杂,细胞间的动态交互和反馈机制不断重塑TME,导致肿瘤对现有治疗手段产生耐药性。
另一个关键问题在于HCC的高度异质性。这种异质性体现在不同患者之间,以及同一患者体内不同肿瘤结节之间,不仅影响预后,也显著影响对治疗的敏感性。因此,开发统一、可重复的实验模型和标准化治疗策略变得异常困难。与此同时,目前常用的动物模型在模拟人类HCC的分子特征和微环境结构方面仍存在局限性,这进一步制约了对TME作用机制的深入探索。
此外,HCC的免疫逃逸机制亦极为复杂。免疫抑制性TME被认为是HCC能够规避免疫系统攻击的主要原因之一,其具体机制包括:
(1)免疫抑制细胞的浸润,如Tregs和MDSCs;
(2)共抑制信号的激活,如PD-1/PD-L1通路;
(3)多种可溶性因子和信号级联反应的调控;
(4)代谢环境的不利变化,如乳酸堆积和缺氧状态;
(5)肠道菌群对肝脏免疫微环境的远程调节等。这些机制共同加剧了免疫调控网络的复杂性,也为治疗带来了更多挑战。
同时,HCC细胞及其所处TME的代谢重编程在调控肿瘤生长、侵袭及转移中扮演重要角色,进一步增加了研究的难度。值得关注的是,尽管中医药在调节HCC微环境方面表现出一定潜力,但现有临床证据在方法学上仍面临诸多问题。目前多数研究受限于样本规模小、缺乏多中心验证、随访时间不足等因素。此外,结局指标的不一致(如RECIST标准与中医证候评价体系并行使用)以及存在干扰因素(如合并接受现代医学治疗)均影响了研究结果的解释力和推广性。
综上所述,HCC肿瘤微环境的高度复杂性、异质性和免疫代谢调控的交叉作用机制,为该领域的基础研究和临床转化带来了巨大挑战;同时也凸显了建立标准化模型、完善方法学设计、以及开展更大规模、规范化临床研究的重要性。
未来方向和研究机会
肝细胞癌(HCC)的发生与进展受多种微环境因素的协同调控,而中医药在调节肿瘤微环境(TME)方面凭借其多成分、多靶点和多通路的综合作用机制,逐渐成为当前研究的重点方向之一。然而,尽管已有研究揭示其潜在价值,仍存在若干关键问题亟需解决:
(1)作用机制尚待深入阐明。当前对于中药调控HCC微环境的机制理解仍不充分。未来应借助先进的多组学技术,如基因组学、转录组学、蛋白质组学与代谢组学,系统性地探讨中药活性成分如何影响TME内的免疫细胞功能、细胞因子的表达调控以及肿瘤相关成纤维细胞(CAFs)的生物学行为,从而揭示其潜在的抗肿瘤作用通路。
(2)靶向中药制剂的开发仍处初期阶段。中医药的显著优势在于其多靶点和协同治疗特性,未来需聚焦于HCC微环境中的关键调控因子,开发更具靶向性和特异性的中药制剂。通过精确识别TME中的关键节点,将有助于提升中药治疗的选择性和干预效果,推动精准治疗策略的发展。
(3)现代药物递送系统的融合应用有待加强。纳米技术等先进药物递送平台为中药在HCC治疗中的应用提供了新的可能。靶向纳米制剂能够有效改善中药活性成分的溶解性、稳定性、穿透能力和体内半衰期,显著提升其生物利用度和药效,同时实现肿瘤组织的精准递送。通过纳米递送系统优化中药的药代动力学特征,是当前中药现代化的核心方向之一。
(4)联合治疗策略的构建亟需系统验证。中医药与现代医学治疗手段(如免疫治疗、靶向治疗、化疗)在HCC治疗中具有较强的互补性。未来研究应进一步评估两者协同应用的治疗效果,并深入探索中医药在增强疗效、缓解毒副作用方面的潜力,从而构建个体化、综合化的治疗模式,以期提升患者的预后及生活质量。
(5)临床转化研究标准亟需规范化与强化。为推进中医药在HCC治疗中的临床应用,应设计高质量的随机对照试验(RCT),建议采用多中心、三期临床设计(样本量≥200例),并延长随访期至至少36个月,以评估长期疗效与安全性。研究需整合西医评价标准(如mRECIST、总生存期)与中医评估体系(如证候评分),同时基于TME相关生物标志物(如细胞因子谱)进行分层随机,并针对主观结局指标实施盲法设计。此外,应通过建立临床研究联盟和证据整合平台,推动核心结局指标的制定与个体参与者数据的共享与荟萃分析,尤其关注罕见HCC亚型的干预研究。
综上所述,中医药在HCC微环境调节中的研究前景广阔。为了实现从实验室探索到临床应用的有效转化,应依托多组学数据驱动的机制研究,发展靶向递药系统,优化联合治疗策略,并基于《CONSORT-TCM扩展指南》开展标准化、高质量的临床试验,从而促进中医药在HCC治疗体系中的科学化和规范化应用。
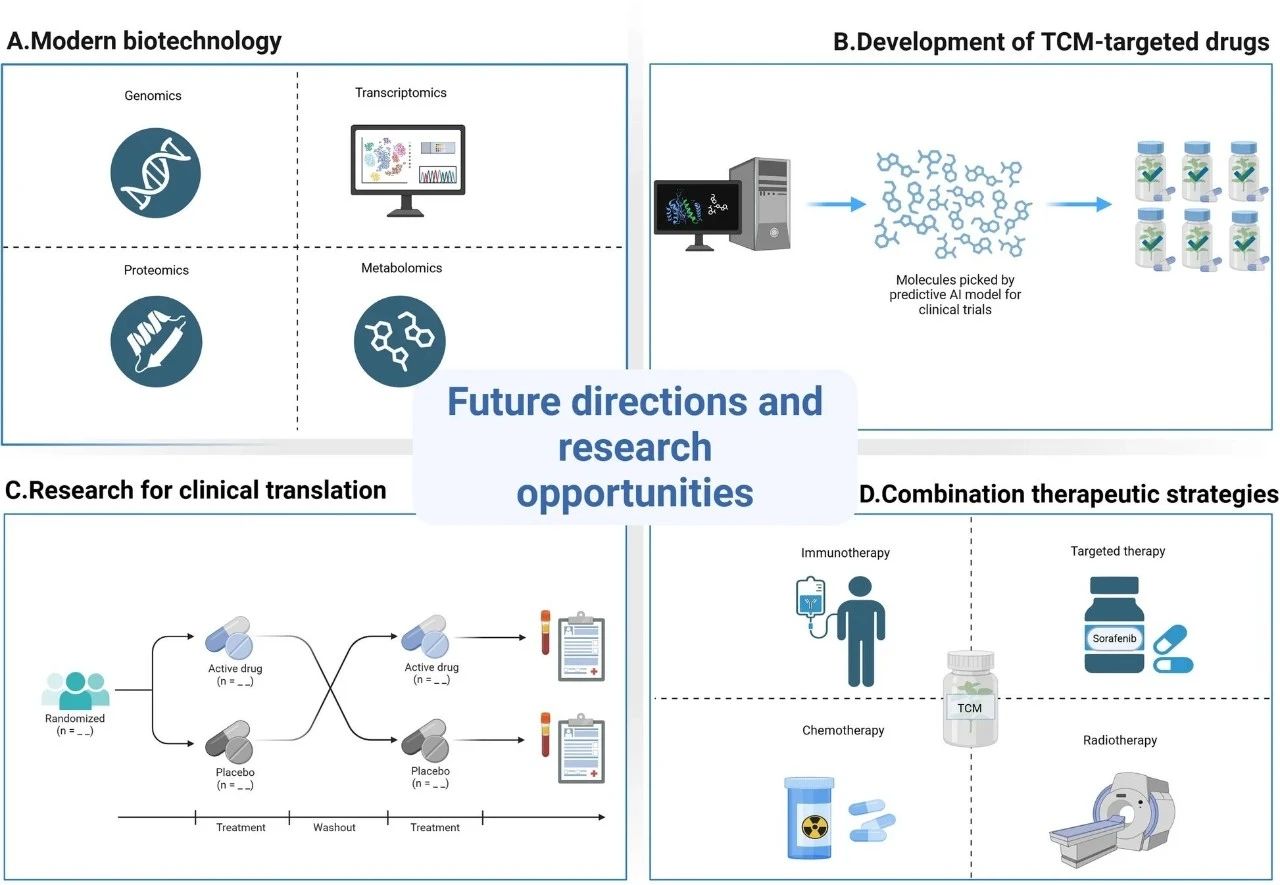
图4 未来方向和研究机会。
A. 现代生物技术(例如基因组学、转录组学、蛋白质组学和代谢组学)被用于研究中药成分通过哪些潜在机制调节TME。
B. 开发针对HCC微环境特定靶点的中药制剂,以提高其在调节TME方面的选择性和有效性,并实现精准治疗。
C. 开展高质量的RCTs,建立涵盖免疫功能和生活质量的多维度评价系统,并推动TCM在HCC治疗中的应用和发展。
D. 将传统中医药与现代医学相结合,评估它们联合应用的效果,并探索中医药在改善治疗效果和减少副作用方面的潜力。
06
结论
中医药(Traditional Chinese Medicine, TCM)在调节肝细胞癌(HCC)相关肿瘤微环境(TME)方面展现出显著的治疗潜能,已逐步成为改善患者预后和提高疗效的重要辅助手段。其独具特色的多靶点、多通路作用机制,使其能够在系统层面调控TME中的多种细胞类型与关键生物分子,从而有效改变肿瘤生存与发展的微环境条件。
具体而言,TCM可通过增强免疫系统功能,缓解TME中存在的免疫抑制状态。它能够激活并促进免疫细胞的增殖与分化,增强其识别和清除肿瘤细胞的能力,从而有效抑制肿瘤的生长与远端转移。与此同时,中医药还具有抗血管生成的作用,能够减少肿瘤对氧气和营养物质的供给,进一步阻断其扩展路径。此外,TCM通过调节多种细胞信号通路、改善代谢状态等手段,促进肿瘤细胞凋亡与坏死,显著加速肿瘤负荷的减少。
TCM的多组分和多靶点特性,使其在应对TME的高度异质性和动态变化方面具有独特优势。例如,它能够平衡多种细胞因子的表达,干预炎症反应、免疫逃逸和纤维化等关键过程,从多个层面重塑微环境,提升肿瘤对治疗的敏感性。这种整体性、系统化的治疗理念不仅为肝癌治疗提供了新的思路,也显著改善了患者的生活质量和长期生存预期。
总之,中医药在调控HCC微环境方面的临床和研究价值不容忽视。其多维度、多通路的综合干预方式,为HCC患者带来了新的治疗可能,拓展了传统治疗的边界。随着机制研究的深入与临床应用的拓展,TCM有望在改善HCC治疗结局、延长患者生存期及提升生活质量方面发挥更加重要的作用。
参考文献:Su X, Yan X, Zhang H. The tumor microenvironment in hepatocellular carcinoma: mechanistic insights and therapeutic potential of traditional Chinese medicine. Mol Cancer. 2025 Jun 10;24(1):173. doi: 10.1186/s12943-025-02378-8. PMID: 40495147; PMCID: PMC12150456.