CUSTOMER
客户中心
助力生命健康领域从基础研究到产业化的加速转化
6.3.4.1体外药物敏感试验
6.3.4.1.1 亚甲蓝法
其原理是利用活细胞的脱氢酶提供氢离子,使亚甲蓝还原为甲烯白(无色)。细胞死亡后,脱氢酶失活,无法使亚甲蓝还原,因此被染成蓝色。检测用药后的死细胞数能反映药物的抑瘤作用。但此方法的假阳性率较高。
6.3.4.1.2 染料排斥试验法
根据活细胞在低浓度染液中不着色的特点,用0.4%台盼蓝或0.1%伊红染料进行。当药物导致细胞死亡时,细胞膜通透性增加,致使染液容易通过细胞膜。加药后计算着色细胞数以示药效。由于某些濒临死亡的细胞不易着色,故假阴性较高,本法不适用于仅抑制细胞分裂或使细胞增殖死亡的药物。比较适用于可使细胞死亡的药物或方法,如血卟啉衍生物加光照射引起的光动力学杀伤作用、高温对癌细胞的破坏作用等。
6.3.4.1.3 生长曲线测定法
瘤细胞在最适条件下呈指数生长,以细胞数的对数与培养时间作图可得一条生长曲线,其线性部分,称对数生长期。加药后药物对细胞生长的影响可通过生长曲线反映出来。本试验可获得3方面的数据:
(1)药物对细胞的杀伤率:将对照及加药组生长曲线的线性部分延伸至Y轴,可分别得到截距No及No’。它们代表接种后具有增殖力的细胞数。药物对增殖细胞的杀伤率=[(No-No’)/No]x100%
(2)药物对倍增时间(DT)的影响:DT计算公式见4.9.3.2节。如果倍增时间延长表明药物使细胞增殖能力减弱。
(3)药物对细胞生长饱和密度(NS)的影响:取处在生长稳定期的培养细胞,计数单位面积或体积的细胞均数,即细胞生长饱和密度。此数值减小也表示细胞增殖活性减弱。
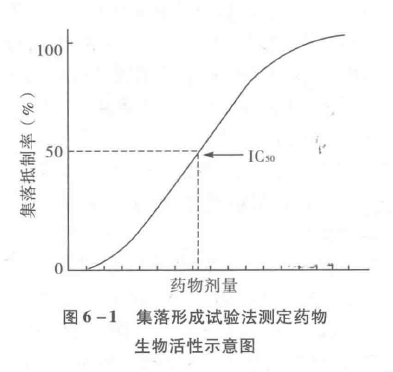
6.3.4.1.4 集落形成试验法
肿瘤系由不同比例的、增殖及分化能力不同的瘤细胞群构成。其中仅小部分具有自我更新能力,即所谓的干细胞,约为整个细胞群的1%。干细胞为放射治疗及抗癌药物治疗的靶细胞,与肿瘤的治愈复发或转移关系密切。一般认为只有干细胞才具有分化、形成集落的能力。故集落法可作为体外检测抗癌药物敏感性方法之具体试验方法见7.1.2节。
根据公式计算集落抑制率,即:
集落抑制率=[1-(试验组集落形成率/对照组集落形成率)x100%在半对数纸上以集落抑制百分率与剂量对数作图,可以得到一条S形曲线并求出药物的ICs值(图6-1)。
或者,求出集落存活分数(S),即:集落存活分数=试验组集落形成率/对照组集落形成率。
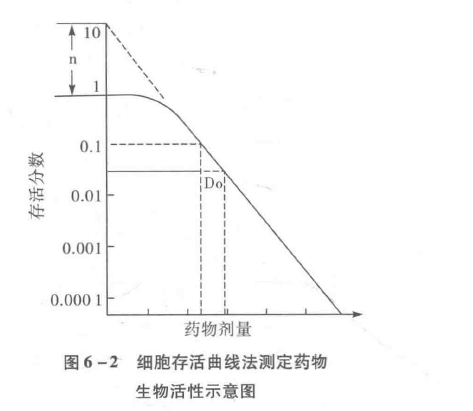
以集落存活分数的对数与剂量作图可以得到细胞存活曲线(图6-2)。由于药物对细胞的杀伤作用一般遵循一级动力学,即一定量的药物杀死一定百分比的细胞,故存活曲线呈带肩区的斜率向下的直线。其方程为S=1-(1-e-D/Do)n。S为存活分数,D为剂量,Do是存活分数在细胞存活曲线中直线部分下降63%所需的剂量,n是曲线指数部分外延至¥轴的截距,称外推值。Do越小,敏感性越高。n反映细胞对药物引起的损伤的修复能力,n越大,表示杀死细胞所需的阈剂量越大。
集落法棁考与临床之阳性符合率约60%~70%,阴性符合率为90%~95%。本法尚存在许多问题:①难获真正单细胞悬液;②)有些肿瘤细胞集落形成率低;③确定集落有一定难度;④耗时长,且重复性差。
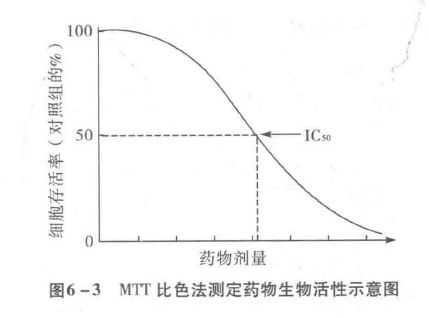
6.3.4.1.5 MTT比色试验法
Mosmann(1983)首先报道用此方法检测细胞活性。以后,其他学者又用此法检测抗癌药物对肿瘤增殖活性的效应。此方法简便、快速,所需细胞数较少,便于大规模进行药物敏感试验,加之人为误差较小而且较精确,没有放射性污染,目前已广泛用于临床前抗癌药物筛选研究,并已开始用于新鲜肿瘤细胞的药物敏感性检测。
具体试验方法见7.1.3节。实验结果以细胞存活率表示,即:
细胞存活率(%)=[试验组光吸收值(A)/对照组光吸收值(A)]x100%一般用细胞存活率对剂量对数作图并按作图法求出IC值(图6-3)。
实验表明,本法与临床有相当好的相关性。
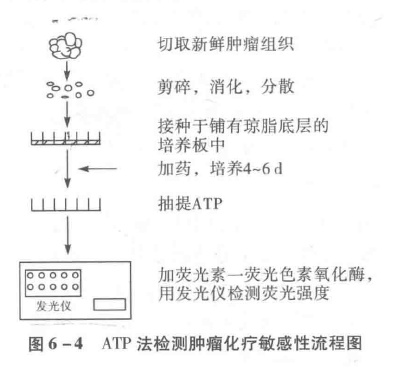
6.3.4.1.6 三磷酸腺苷生物发光法
该法是一种敏感、可靠的、能测定各种细胞活力的方法(见7.1.4节)。与集落形成法,放射性同位素掺入法及染料排斥法均有良好的相关性。Perra(1987)首先将此方法用于新鲜瘤组织的药敏检测,是体现药物对全体瘤细胞群杀伤的体外药敏方法,该试验周期较短,与临床相关性较好。进行药物敏感试验时,需预先在培养板的孔底铺一层0.5%琼脂培养基以防正常细胞生长,然后接种肿瘤细胞,加药物培养一定时间,测定细胞内ATP活性。试验流程见图6-4。一组实体瘤的实验表明,其临床精确预测率为88.8%。
加药组发光强度下降超过对照组70%为强敏感;下降超过对照的50%,但未达70%者为部分敏感;而下降低于对照的50%时,视为耐药反应。
6.3.4.1.7 放射性同位素掺入核苷酸前体物试验法
常用3H-TdR或3H-UdR人处于DNA或RNA合成期的细胞,用液体闪烁计数仪,可测知3H-TdR或3H-UdR标记的DNA或RNA含量,从而可了解药物对肿瘤细胞DNA或RNA合成之抑制效应。自1976年Mattem等采用此方法作体外药敏试验以来,经过许多年的广泛研究,目前已证实对各种动物肿瘤及人类肿瘤,均有较好的预测价值和重复性,且方法简便、快速。有关方法见7.2.3节。通过测定DNA含量,首先判断该肿瘤的增殖情况。离体肿瘤细胞在3h内可继续合成DNA,故此方法结果可真实地反映肿瘤细胞的增殖水平,也可测知作用于细胞增殖期的药物的效果。
6.3.4.1.8 3H-亮氨酸掺入细胞蛋白质试验法
亮氨酸是机体必需氨基酸,利用其掺人量变化,可检测抗癌药物对细胞蛋白质合成的影响程度。有关方法见7.1.6节。
6.3.4.1.9 抗癌药的效能比测定法
肿瘤化疗中常见的副作用是药物对正常组织的毒性,对增殖较快的造血等组织的毒性尤为常见。造血细胞增殖活性高,往往是抗癌药毒性的主要靶细胞。因此,抗癌药的效能比测定一般选用造血细胞作为正常细胞的代表。在体外同时测定某药对癌细胞及正常细胞的细胞毒作用,可计算出该药在细胞水平上的效能比。
现介绍一种小鼠骨髓基质集落形成细胞(CFU-F)测定法。
概述
骨髓基质主要由成纤维样细胞、内皮细胞及巨噬细胞组成,基质损伤可导致造血干细胞增殖及分化的障碍。因此,测定骨髓基质细胞在体外培养条件下的集落形成能力可反映药物对正常组织细胞的毒性作用。
用品
McCoy’s 5A培养液(可用RPMI1640培养液代用、但效果不佳)、胎牛血清抗癌药、甲醇、Giemsa 染色液。
解剖刀、眼科弯剪、弯镊子、吸管注射器、计数板、移液器、直径35mm塑料培养皿、立体显微镜、CO2孵箱。
步骤
(1)取3只小白鼠,用脱颈法处死小鼠,无菌条件下分离出股骨,剪断骨干,用注射器冲洗出骨髓细胞,将细胞悬浮在培养液中,通过4.5号针头使之分散成单个细胞悬液,计数。
(2)用含15%胎牛血清的培养液将细胞密度调整为3.6x106个/mL,取1.4mL细胞悬液加入塑料培养皿中,并加测试药物 4 μL。
(3)将培养皿放入孵箱,在37℃、5%CO2、5%O2,及90%N2条件下培养7d。
(4)弃去培养液,甲醇固定10min Giemsa染液染色15 min,水洗,晾干。
(5)解剖镜下计数集落数。
(6)以相同方法测定药物对肿瘤细胞集落形成的影响。
结果分析
药物的效能比=造血细胞的 Do/肿瘤细胞的 Do,也可用IC50代替。效能比=1,表示该药物对肿瘤细胞的杀伤无选择性。效能比越大,表示药物对肿瘤细胞抑制的选择性越强。Do为致死剂量。