CUSTOMER
客户中心
助力生命健康领域从基础研究到产业化的加速转化
一、解剖取材
(一)大、小鼠脑取材方法
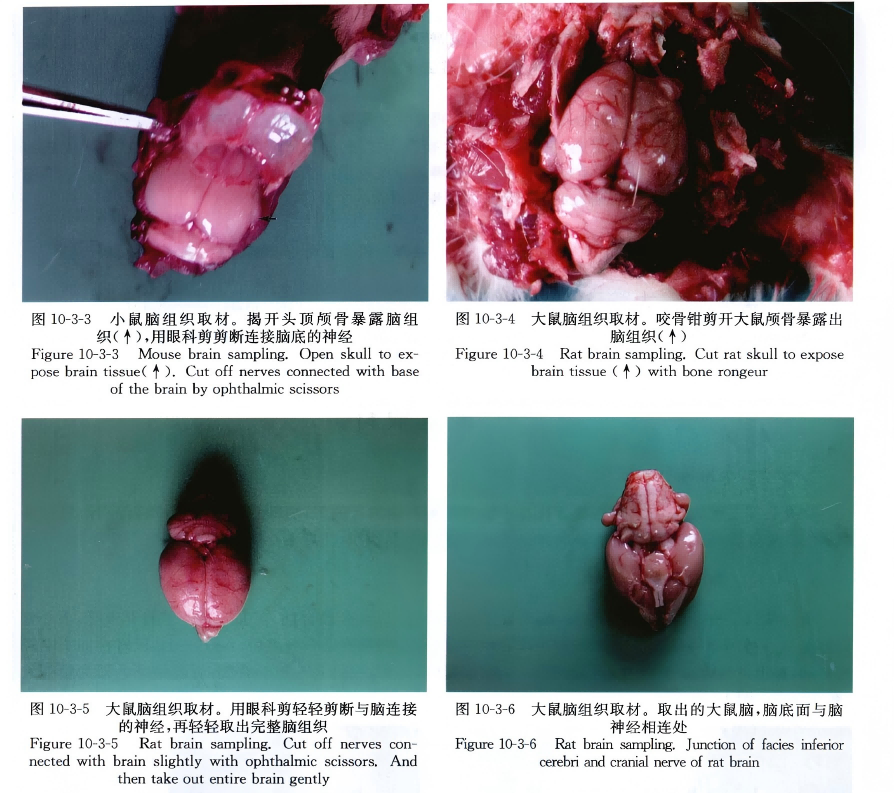
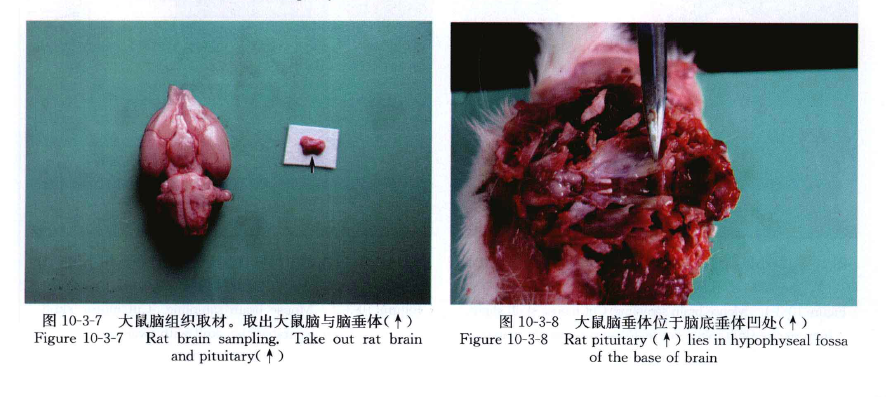
剥开头部皮肤暴露出颅骨,在枕骨孔与小脑的间隙一端插入剪刀,剪断双侧组织,分离开颅骨,揭开头顶部颅骨暴露脑,用小解剖剪剪断脑底神经,轻轻剥离摘出脑组织,注意不要损伤脑组织。
(二)大鼠脊髓取材方法
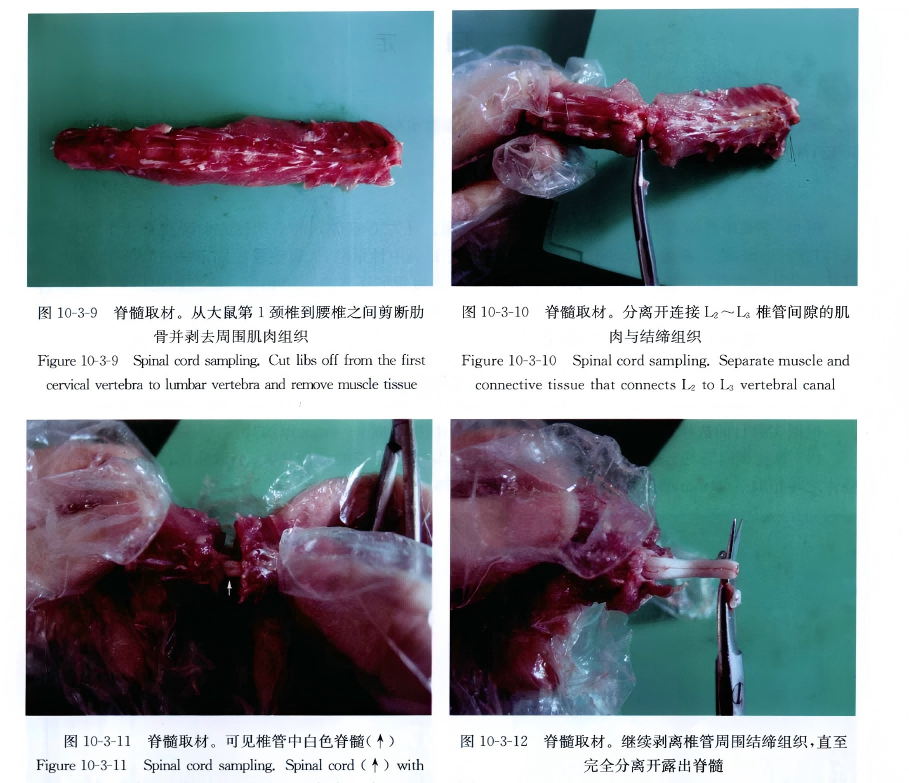
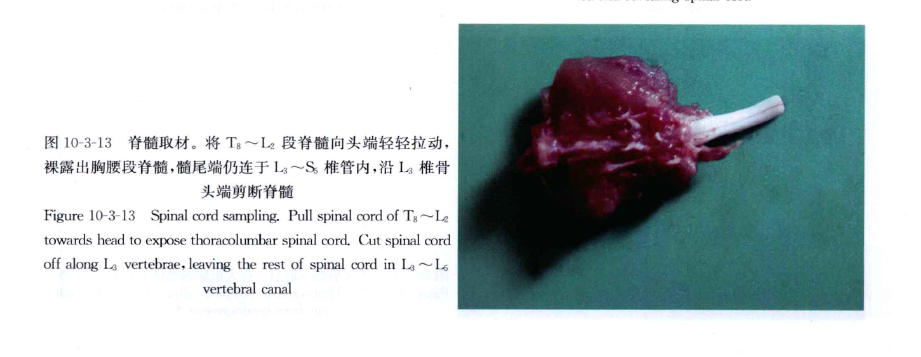
剪去从第1颈椎至腰椎间的肋骨,剥离脊柱肌肉,取下T8~S5段脊柱,在L2~3椎间隙打开椎管,小心分离连接在L2~3。椎间隙的肌肉及韧带,即可见椎管中白色脊髓,韧带等完全分离后,将T8~L2段脊椎向头端轻轻拉动,即可见胸腰段脊髓,尾端仍连于L3~S5,椎管内,沿L3椎骨头端剪断脊髓,脊髓最宽处即为腰膨大(图10-3-1~图 10-3-13)。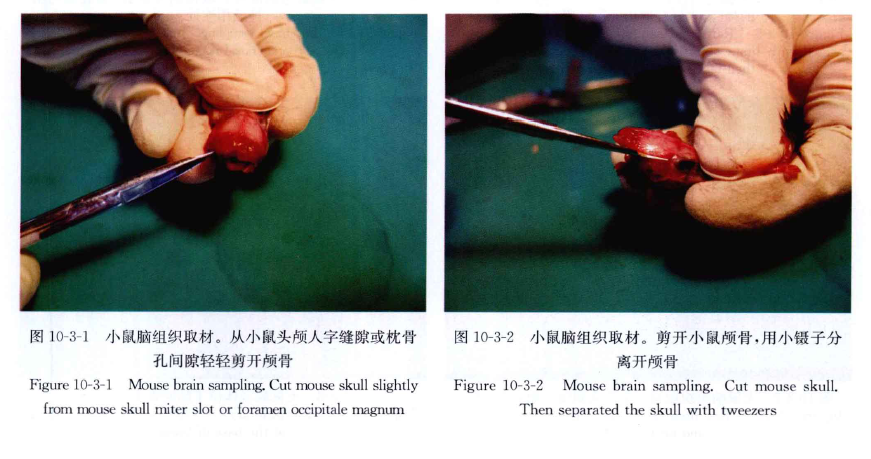
二、固定
(一)浸泡固定
将取出脑、脊髓,立即放入 10%中性甲醛或4%多聚甲醛固定液中固定。固定液量是组织体积的 30~50倍,荡振荡固定,促进固定液渗入脑组织内。
(二)灌注固定
用4%多聚甲醛液或 10%中性甲醛进行灌注固定。从左心室进入向主动脉方向缓缓推入生理盐水冲洗,切开右心房,流出液无色后再推入4%多聚甲醛或 10%中性甲醛,大鼠脑灌注固定每只300~350ml。也可从颈动脉插管或局部血管灌注固定,灌注压力应与该血管的正常血压值相应。灌注固定后剥开头皮,充分暴露出颅骨从颅骨中线或枕骨大孔两侧剪开,剥开颅骨暴露出大脑组织,用眼科剪轻轻剪断脑底各相连神经,取出完整脑组织,继续浸泡固定48~72小时。
三、固定后取材
根据实验目的选择取材部位,将固定后的大鼠、小鼠脑切成3~4mm厚脑片。
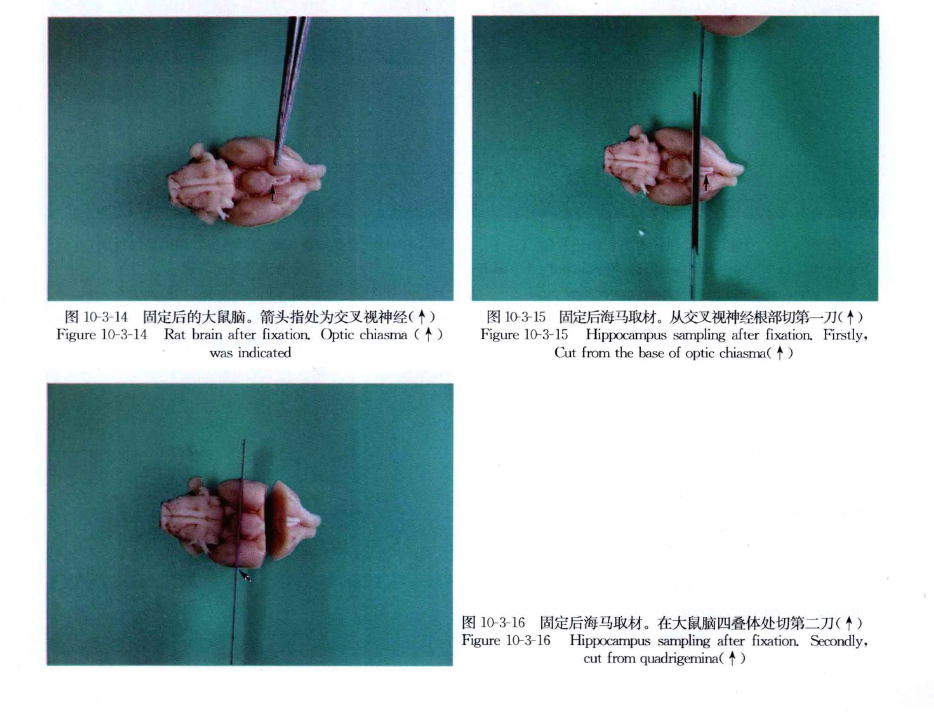
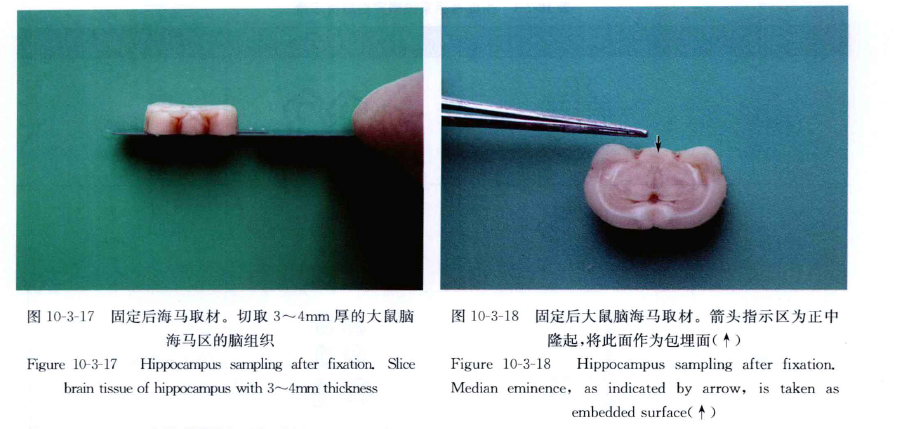
(1)如要观察海马、正中隆起、饱食中枢、弓状核,切取脑组织的部位从大、小鼠脑视神经交叉根部与四叠体之间切取 3~4mm厚脑片(图10-3-14~图10-3-18)。
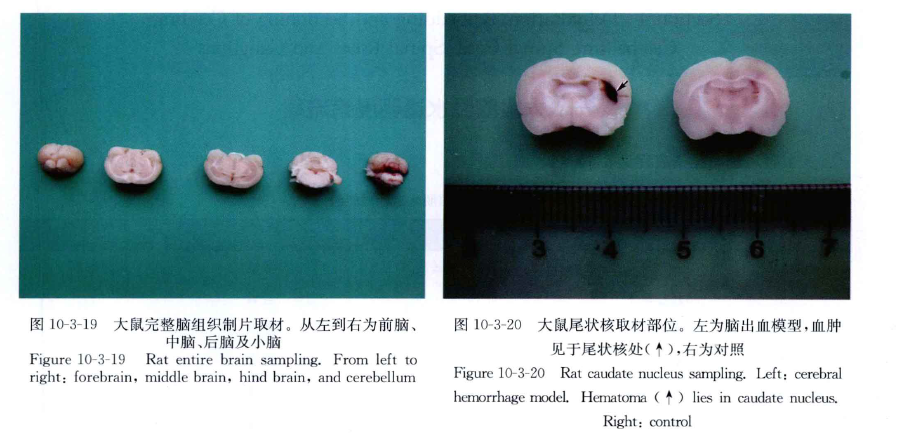
 (2)完整大鼠脑的取材方法(图10-3-19)。
(2)完整大鼠脑的取材方法(图10-3-19)。
(3)大鼠尾状核脑出血模型取材:血肿见于尾状核,切取3~4mm脑片(图10-3-20)。
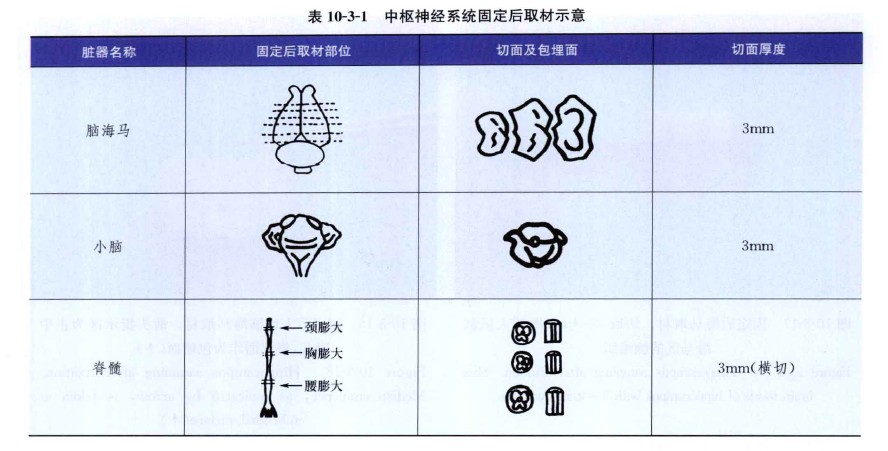
(4)大鼠脊髓取材:切取3~4mm厚横断面和纵断面(表10-3-1)。
(5)大鼠背根神经节取材:将完整背根神经节用一次性帽子纸包好脱水放入包埋盒流水冲洗后进入脱水包埋程序。
四、注意事项
新鲜取材后要立即放入固定液中固定;根据观察目的确定取材部位,取材时脑解剖学位置要放正、固定稳后再切,不能切歪切斜,可用标准的脑槽切取脑片;脑组织含水分较多,取材刀片一定要锋利,尽量不按压组织;固定后取材的脑组织不能干燥,可补给些水分取材。