CUSTOMER
客户中心
助力生命健康领域从基础研究到产业化的加速转化
From: Nature Communications,IF=16.6

Abstract
Mitochondria-ER membrane contact sites (MERCS) represent a fundamental ultrastructural feature underlying unique biochemistry and physiology in eukaryotic cells. The ER protein PDZD8 is required for the formation of MERCS in many cell types, however, its tethering partner on the outer mitochondrial membrane (OMM) is currently unknown. Here we identify the OMM protein FKBP8 as the tethering partner of PDZD8 using a combination of unbiased proximity proteomics, CRISPR-Cas9 endogenous protein tagging, Cryo-electron tomography, and correlative light-electron microscopy. Single molecule tracking reveals highly dynamic diffusion properties of PDZD8 along the ER membrane with significant pauses and captures at MERCS. Overexpression of FKBP8 is sufficient to narrow the ER-OMM distance, whereas independent versus combined deletions of these two proteins demonstrate their interdependence for MERCS formation. Furthermore, PDZD8 enhances mitochondrial complexity in a FKBP8-dependent manner. Our results identify a novel ER-mitochondria tethering complex that regulates mitochondrial morphology in mammalian cells.
摘要
线粒体与内质网膜接触位点(MERCS)是真核细胞中一种基本的超微结构特征,其在细胞的独特生物化学和生理学中发挥着重要作用。内质网蛋白PDZD8在许多细胞类型中对于MERCS的形成是必需的,然而其在线粒体外膜(OMM)上的锚定伙伴目前尚不清楚。在本研究中,我们通过结合无偏的邻近蛋白质组学、CRISPR-Cas9内源性蛋白标签、冷冻电子断层扫描和相关光电子显微镜技术,鉴定出线粒体外膜蛋白FKBP8是PDZD8的锚定伙伴。单分子跟踪揭示了PDZD8沿内质网膜的高度动态扩散特性,以及在MERCS处的显著停顿和捕获。FKBP8的过表达足以缩小内质网与线粒体外膜之间的距离,而PDZD8和FKBP8的独立或联合敲除则表明它们在MERCS形成中相互依赖。此外,PDZD8以FKBP8依赖的方式增强线粒体的复杂性。我们的研究结果揭示了一个新的内质网-线粒体锚定复合体,该复合体调节哺乳动物细胞中线粒体的形态。
内容总结
1. 背景知识
MERCS的定义:内质网和线粒体之间的接触位点(MERCS)是真核细胞中一种独特的超微结构特征,两个膜之间的距离在10-50纳米之间,这种结构在单细胞真核生物和后生动物中是保守的。
PDZD8的作用:PDZD8是一种内质网蛋白,对于许多细胞类型中MERCS的形成是必需的,但在其与线粒体外膜(OMM)的结合伙伴目前尚不清楚。
2. 研究方法
蛋白质相互作用筛选:研究者使用了无偏的邻近蛋白质组学、CRISPR-Cas9内源性蛋白标签、冷冻电子断层扫描(Cryo-EM tomography)和相关光电子显微镜(CLEM)等技术来鉴定PDZD8的结合伙伴。
单分子跟踪:通过单分子跟踪技术揭示了PDZD8沿内质网膜的高度动态扩散特性,以及在MERCS处的显著停顿和捕获。
基因敲除和过表达实验:通过独立或联合敲除PDZD8和FKBP8基因,研究它们在MERCS形成中的相互依赖性。
电子显微镜技术:使用扫描电子显微镜(SEM)和冷冻电子断层扫描(cryo-ET)来观察和量化MERCS的超微结构特征。
3. 实验结果
PDZD8与FKBP8的相互作用:通过一系列的实验,研究者发现线粒体外膜蛋白FKBP8是PDZD8的结合伙伴。PDZD8和FKBP8之间的相互作用是直接的,并且这种相互作用对于MERCS的形成是必需的。
PDZD8和FKBP8在MERCS形成中的作用:实验表明,PDZD8和FKBP8在MERCS的形成中相互依赖。PDZD8的过表达可以缩小内质网和线粒体之间的距离,而PDZD8和FKBP8的独立或联合敲除则会破坏MERCS的形成。
PDZD8对线粒体复杂性的影响:PDZD8通过抑制FKBP8的功能来增强线粒体的复杂性。在PDZD8敲除的细胞中,线粒体的形态更加简单,而在FKBP8敲低的细胞中,线粒体更加延长和分支。
超微结构分析:通过冷冻电子断层扫描技术,研究者发现过表达FKBP8N403K(一种锁定在线粒体外膜的FKBP8突变体)可以显著缩小内质网和线粒体之间的距离。
4. 关键结论
PDZD8-FKBP8复合体:PDZD8和FKBP8形成一个复合体,这个复合体在调节线粒体形态中起着关键作用。
MERCS的形成机制:PDZD8和FKBP8的相互作用对于MERCS的形成是必需的,这种相互作用可能代表了一种新的ER-线粒体锚定机制。
线粒体复杂性的调节:PDZD8通过抑制FKBP8的功能来增强线粒体的复杂性,这可能对于维持细胞内稳态和细胞功能至关重要。
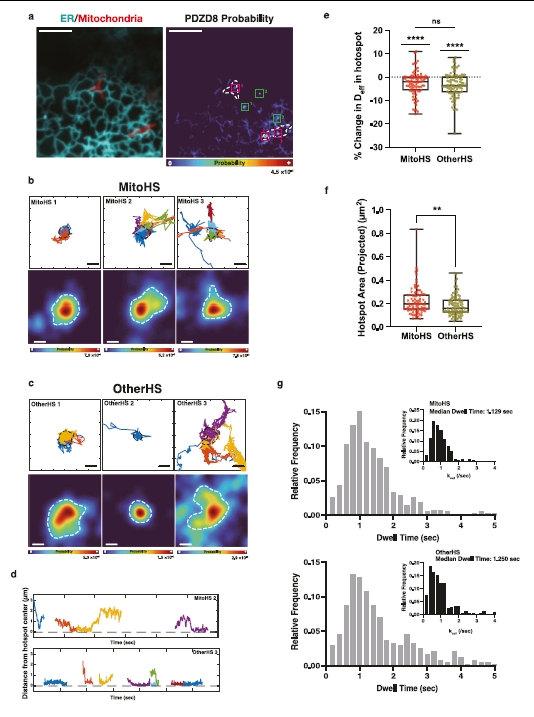
图1 | PDZD8在靠近线粒体的热点区域显示出高速单分子追踪。
a. 展示了代表性COS7细胞周边的内质网(ER,青色)和线粒体(红色)的衍射极限成像,以及在1分钟窗口内找到PDZD8分子可能性的测量。线粒体在概率图中的位置用虚线表示。框对应于b和c中的线粒体相关热点(MitoHS,品红色)或非线粒体相关热点(OtherHS,绿色)。数据代表来自两个独立实验的14个细胞。
b. a中MitoHS的放大图,显示了与热点区域接触的单个PDZD8轨迹和相关的PDZD8概率密度。虚线表示用于后续分析的热点边界。
c. a中OtherHS的放大图,显示了与热点区域接触的单个PDZD8轨迹和相关的PDZD8概率密度。虚线表示用于后续分析的热点边界。
d. 显示了不同颜色的单个PDZD8分子与示例热点中心的距离随时间变化的图。图来自MitoHS 2(上图)或其他HS 3(下图)。
e. PDZD8在两类热点区域内显示出比在周围ER中自由扩散时减少的扩散。n = 89和99个热点对应于MitoHS和其他HS。使用双侧Mann–Whitney检验比较MitoHS中2D Deff减少的百分比,使用单样本Wilcoxon符号秩检验比较假设中位数(0)和MitoHS或其他HS中2D Deff减少的中位数。ns: p > 0.05, ****p < 0.0001。数据以箱形图表示,中心表示中位数,25和75百分位数由箱形图表示。须延伸到最小和最大值。
f. MitoHS的大小显著大于同一细胞中的OtherHS。n = 89和99个热点对应于MitoHS和OtherHS。数据以箱形图表示,中心表示中位数,25和75百分位数由箱形图表示。须延伸到最小和最大值。使用双侧Mann–Whitney检验进行统计分析。**p = 0.0065。
g. PDZD8在单个MitoHS和其他HS中的停留时间。插图显示了与线粒体相关或不相关的单个PDZD8分子从概率热点离开的频率(kout)。比例尺:a 5 µm,b,c 100 nm。
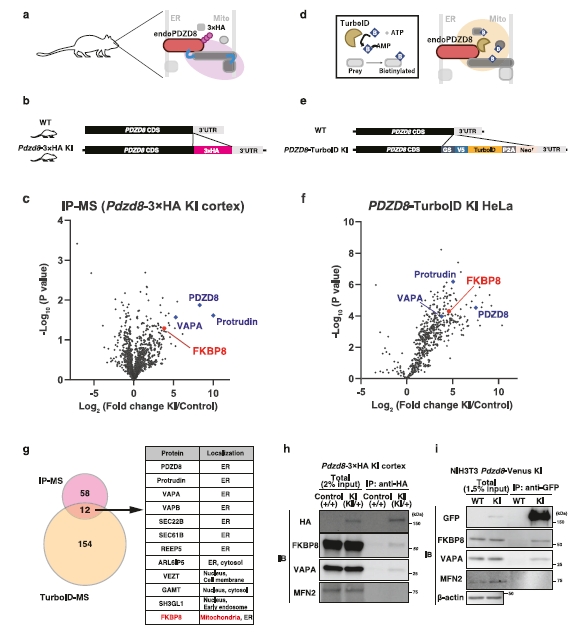
图2 | 蛋白质组学筛选识别PDZD8–FKBP8蛋白复合体。
a. 使用Pdzd8-3×HA KI小鼠新皮质的免疫沉淀和LC–MS/MS分析方案。使用抗HA抗体从Pdzd8-3×HA小鼠或对照小鼠的新皮质中进行免疫沉淀,然后进行LC–MS/MS分析。
b. 描述Pdzd8-3×HA KI小鼠基因组序列的图。在Pdzd8编码序列的C端敲入3×HA标签序列。
c. 与PDZD8-3×HA结合的蛋白质差异结合的火山图。FKBP8用红色标记。Protrudin和VAPA,以前报道与PDZD8相互作用的蛋白质,用蓝色标记。该图表示三个生物学重复的数据。p值使用未调整的双尾学生t检验计算。
d. 使用内源性PDZD8的邻近标记方案的方案。与PDZD8融合的生物素连接酶TurboID从生物素和ATP生成生物素–5′-AMP。生物素–5′-AMP可以与内源性表达的PDZD8-TurboID附近大约20 nm的蛋白质共价结合。
e. 描述PDZD8-TurboID KI HeLa细胞基因组序列的图。TurboID-P2A-Neor序列在PDZD8编码序列的C端敲入。
f. 在PDZD8-TurboID KI HeLa细胞中用生物素差异生物素化的蛋白质的火山图。FKBP8用红色标记。Protrudin和VAPA,以前报道与PDZD8相互作用的蛋白质,用蓝色标记。火山图表示三个生物学重复。p值使用未调整的双尾学生t检验计算。
g. IP–MS(c)和TurboID-MS(f)中高度富集的蛋白质数量在维恩图中显示。两个蛋白质组中共同发现12种蛋白质。注意,FKBP8是唯一被注释为线粒体定位的蛋白质。
h,i. 使用Pdzd8-3×HA KI小鼠(h)或Pdzd8-Venus KI NIH3T3细胞(i)的内源性FKBP8和内源性PDZD8-3×HA的相互作用分析。从Pdzd8-3×HA KI小鼠的新皮质(h)或Pdzd8-Venus KI NIH3T3细胞(i)中提取的提取物分别用HA或GFP抗体进行免疫沉淀。原始组织提取物(总计)和沉淀物分别用FKBP8、VAPA、MFN2、HA(h)、GFP(i)和β-actin(i)抗体进行免疫印迹分析。数据代表三个独立实验。
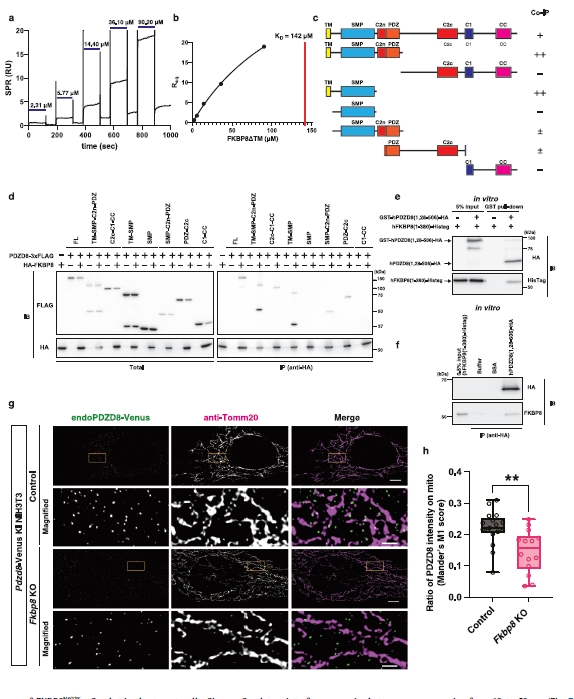
图3 | 直接结合伙伴FKBP8是需要PDZD8在线粒体上招募的。
a. SPR测定的传感器图。重组人PDZD8(1, 28–)-FLAG固定在传感器芯片上,注射不同浓度的FKBP8(1–380)-Histag。
b. 将平衡时的SPR响应(Req)与FKBP8浓度作图。将Req与FKBP8浓度的滴定曲线拟合到单价结合模型以确定KD值。
c. 各种结构域删除的PDZD8突变体的示意图。TM跨膜,SMP类似突触小泡蛋白样线粒体脂质结合,C2n C2结构域N端序列,PDZ PDZ结构域,C2c C2结构域C端序列,C1 C1结构域,CC 卷曲螺旋区域。
d. Pdzd8f/f::CreERT2MEFs表达一系列删除突变体PDZD8-3×FLAG,并与HA标记的FKBP8共同处理1 μM 4-羟基他莫昔芬(4-OHT),细胞提取物用抗HA抗体免疫沉淀。用抗HA抗体和抗FLAG抗体进行Western blotting。数据代表三个独立实验。
e. 体外混合重组GST–切割位点–人PDZD8(1, 28–506)–HA和重组人FKBP8(1–380)–Histag的GST拉下测定。仅当与GST-PDZD8(1, 28–506)–HA孵育时,FKBP8–Histag才从GST珠中洗脱。数据代表两个独立实验。
f. 使用相同一组纯化蛋白和抗HA抗体进行的HA拉下测定。与hPDZD8(1, 28–506)–HA孵育时,FKBP8-Histag富集,与阴性对照(缓冲液或含BSA的缓冲液)相比。数据代表两个独立实验。
g. 通过共聚焦显微镜和Nikon空间阵列共聚焦(NSPARC)检测器对Pdzd8-Venus KI NIH3T3细胞敲除内源性FKBP8的免疫荧光分析。细胞转染了对照gRNA(上两行)或针对FKBP8的三个gRNA(下两行),Cas9和转染标记mtagBFP2,并用GFP和Tomm20抗体染色以可视化内源性PDZD8-Venus(绿色)和线粒体外膜(品红色)。比例尺:5 µm(原始)1 µm(放大)。
h. 内源性PDZD8-Venus与线粒体(Tomm20阳性区域)重叠强度百分比的定量。数据以箱形图表示,中心表示中位数,25和75百分位数由箱形图表示。须延伸到最小和最大值。n = 17, 14个对照和FKBP8 KO细胞。使用双侧Mann–Whitney U检验进行统计分析。**p = 0.003。
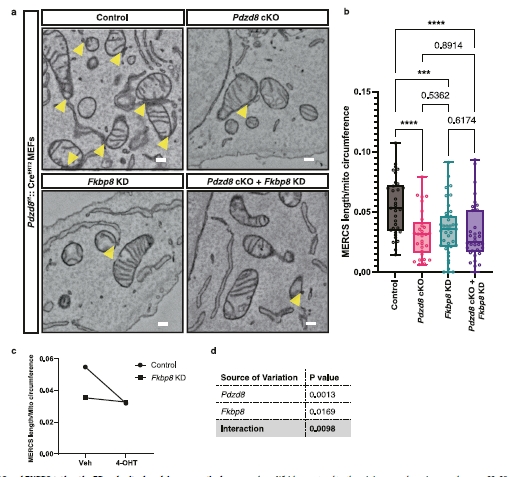
图4 | PDZD8和FKBP8共同需要形成MERCS。
a. 用慢病毒携带shControl或shFKBP8感染的Pdzd8f/f::CreERT2 MEFs的代表性电子显微图,以及用或不用0.5 µM 4-OHT处理。MERCS(黄色箭头)在对照细胞中比在Pdzd8 cKO、Fkbp8 KD和Pdzd8 cKO + Fkbp8 KD细胞中更频繁观察到。比例尺:200 nm。
b. 通过线粒体周长归一化的MERCS长度的定量。数据以箱形图表示,中心表示中位数,25和75百分位数由箱形图表示。须延伸到最小和最大值。n = 33, 29, 39, 34个细胞来自两个独立实验,分别为对照、Pdzd8 cKO、Fkbp8 KD和Pdzd8 cKO + Fkbp8 KD细胞。使用单因素方差分析和Fisher的LSD检验进行统计分析。****p < 0.0001, ***p = 0.0003。
c. 对应于b的交互图。点显示每种条件的平均值。
d. 双向方差分析测试的结果。交互作用的低(<0.01)变化表明PDZD8和FKBP8共同影响MERCS的面积。
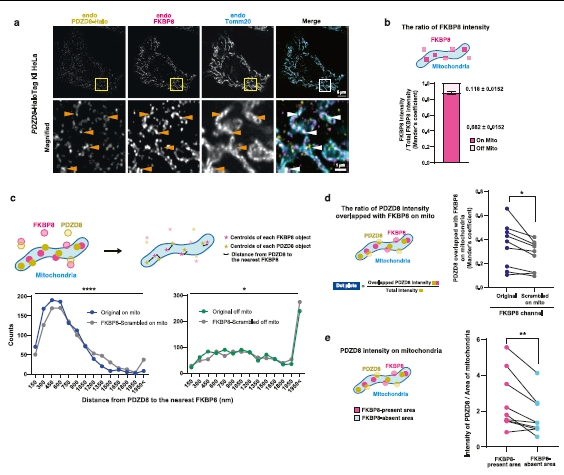
图5 | 内源性PDZD8和FKBP8在线粒体上共定位。
a. PDZD8-Halotag KI HeLa细胞的免疫荧光分析。细胞用200 nM的Janelia Fluor 549处理20小时,然后用FKBP8和Tomm20抗体染色。上图的框选区域在相应的下图中放大显示。箭头指示PDZD8与FKBP8和Tomm20共定位。比例尺,5 μm(原始)或1 μm(放大)。
b. 图a中获得的图像中FKBP8强度在或在线粒体外(off)的比率确定。误差条是两个独立实验的九个细胞的平均值±s.e.m.。三个细胞质区域的平均值用于分析。
c. 使用OpenCV的connected Components With Stats函数,在PDZD8和FKBP8的二值化图像中分割PDZD8和FKBP8的点,然后获得单个点的质心。通过在显示FKBP8质心的图像中使用Tomm20的二值化图像进行掩蔽,定义“在线粒体上”或“在线粒体外”区域的质心。使用Python的random模块在相应区域中打乱FKBP8的像素以获得打乱的FKBP8图像。分别在“在线粒体上”、打乱的“在线粒体上”、“在线粒体外”和打乱的“在线粒体外”图像中创建FKBP8的距离图。然后计算PDZD8点与最近FKBP8的距离对应于图中x轴的每个bin的数量。
d. 为了计算PDZD8和FKBP8在线粒体上的Manders系数,计算了FKBP8存在线粒体区域的PDZD8强度总和除以线粒体上的总PDZD8强度。通过在FKBP8通道内使用Python的random模块打乱线粒体区域内的像素来创建打乱的FKBP8图像。
e. 使用Tomm20和FKBP8的二值化图像定义FKBP8存在或不存在的线粒体区域作为ROI,然后计算ROIs的PDZD8强度总和除以ROIs的面积。图S7d,e中的图像分析使用与图5d,e相同的方法进行。在图6a,b中,使用YFP-ActA信号作为指导,手动定义ROIs为细胞质区域。通过Otsu方法对YFP-ActA的二值化图像定义线粒体区域,然后计算线粒体上的PDZD8强度百分比(Manders系数,M1)。
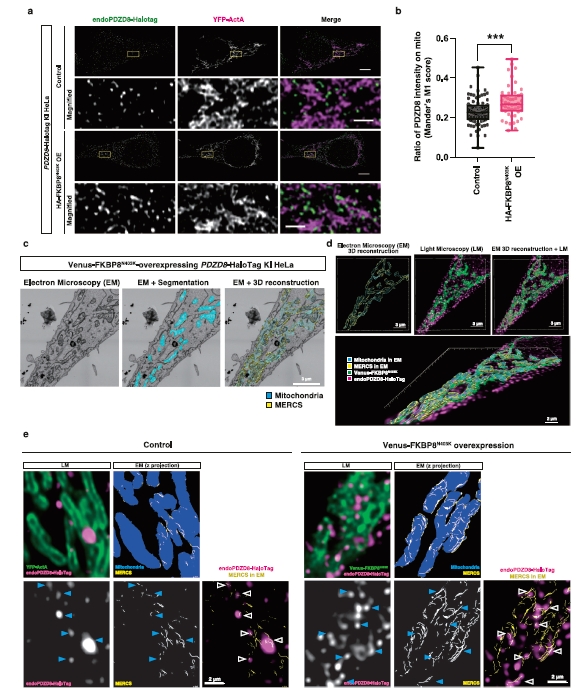
图6 | 过表达线粒体FKBP8招募内源性PDZD8到线粒体附近。
a. 过表达HA-FKBP8N403K的PDZD8-Halotag KI HeLa细胞的免疫荧光分析。转染对照质粒(上两行)或编码HA-FKBP8N403K的质粒(下两行),以及线粒体标记YFP-ActA的细胞,用200 nM的JF549处理20小时,然后固定细胞用共聚焦显微镜和Nikon空间阵列共聚焦(NSPARC)检测器观察。比例尺:5 µm(上图),1 µm(放大图)。
b. 内源性PDZD8-Halotag与线粒体(YFP-ActA阳性区域)重叠强度百分比的定量。数据以箱形图表示,中心表示中位数,25和75百分位数由箱形图表示。须延伸到最小和最大值。n = 78, 48个对照和FKBP8N403K过表达细胞来自两个独立实验。使用双侧学生t检验进行统计分析。***p = 0.0007。
c–e. 在PDZD8-HaloTag KI HeLa细胞中进行相关光和电子显微镜(CLEM)分析。过表达Venus-FKBP8N403K或YFP-ActA(作为对照)的细胞用200 nM的JF549处理20小时,然后用共聚焦显微镜观察固定细胞。然后,创建50 nm厚的超薄切片,并在场发射扫描电子显微镜(FE–SEM)中观察。电子显微图的连续8切片对应于荧光图像的一个光学切片。在电子显微图中分割和三维(3D)重建线粒体和距离线粒体25 nm内的内质网(MERCS)如c所示。从电子显微图(显示为“EM”)进行的3D重建与荧光图像(显示为“LM”)如d所示合并。电子显微图中线粒体和MERCS的z投影与荧光图像如e所示重叠。箭头指示定位于MERCS的PDZD8点。
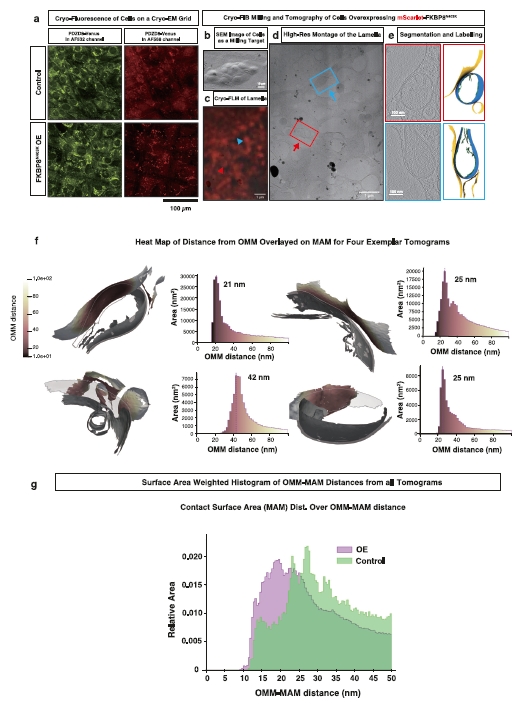
图7 | 过表达线粒体FKBP8N403K缩小MAM和线粒体之间的距离。
a. FKBP8N403K过表达增加了PDZD8-Venus点的强度和丰度。在低温下,NIH3T3细胞在绿色通道中的自发荧光很强,因此在对照细胞中存在点。Venus荧光团也在红色通道中发射光。图像代表对照和FKBP8N403K OE的两个堆栈(视场:638.9 µm2)。
b–e 对于冷冻电子断层扫描(cryo-ET)分析,使用mScarlet-FKBP8N403K过表达(OE)来增加在冷冻FIB铣削的薄片中捕获的线粒体和线粒体相关膜(MAM)之间的关联数量。显示目标细胞在Cryo-FIB铣削前的SEM图像(b)。冷冻荧光成像证实目标细胞中存在mScarlet-FKBP8N403K。注意,冷冻荧光图像和冷冻TEM之间的明显不匹配是由于包括自发荧光、分辨率差异、注册误差、成像平面中的扭曲和冰晶污染等因素造成的(c)。使用薄片的中分辨率TEM拼接图,针对具有MAM的线粒体进行高分辨率倾斜系列采集(d)。对于OE条件,获得了80个包含MAM的断层图(其中20个完全分割和标记),对于对照条件,获得了10个包含MAM的断层图(其中6个完全分割和标记)。显示OE条件的两个代表性断层图对应于面板(d)中的箭头(e)。图像b代表超过35个细胞。图像c代表13个薄片。FLM:荧光光显微镜。f 使用表面形态测量分析计算MAM-线粒体外膜(OMM)距离。距离显示为热图。g 面积加权MAM–OMM距离直方图的总体分析显示,在过表达条件下与对照相比距离更小。
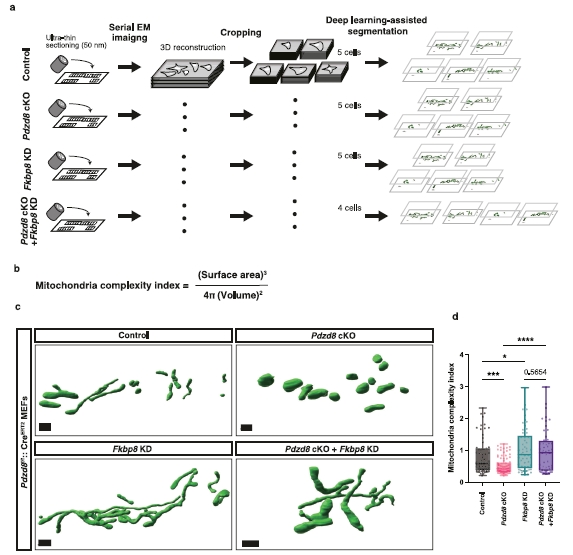
图8 | 体积EM分析揭示PDZD8通过抑制FKBP8促进线粒体复杂性。
a. 通过体积EM进行线粒体形态分析的示意图。通过FE–SEM获取连续切片的串行电子显微图。在裁剪体积后,使用AI辅助管道半自动提取体积中的线粒体。
b. 计算MCI(线粒体复杂性指数)的公式42。MCI计算为SA3/(16π2V2),其中SA是表面积,V是每个线粒体的体积(见方法部分的详细信息)。
c. PDZD8 cKO细胞的代表性3D重建,这些细胞来自用携带shControl或shFKBP8的慢病毒感染并用或不用0.5 µM 4-OHT处理的Pdzd8f/f::CreERT2 MEFs。比例尺:1 µm。d. MCI(线粒体复杂性指数)42的定量。数据以箱形图表示,中心表示中位数,25和75百分位数由箱形图表示。须延伸到最小和最大值。n = 63, 90, 54, 和 52个线粒体来自5, 5, 5, 和 4个细胞,分别为对照、Pdzd8 cKO、Fkbp8 KD和Pdzd8 cKO + Fkbp8 KD条件。使用单因素方差分析和Fisher的LSD检验进行统计分析。****p < 0.0001, ***p = 0.0006, *p = 0.033。