CUSTOMER
客户中心
助力生命健康领域从基础研究到产业化的加速转化
From: Nature Communications,IF=14.7
摘要
Suppression of chimeric antigen receptor-modified T (CAR-T) cells by the immunosuppressive tumor microenvironment remains a major barrier to their efficacy against solid tumors. To address this, we develop an anti-PD-L1-expressing nanovesicle loaded with the STING agonist cGAMP (aPD-L1 NVs@cGAMP) to remodel the tumor microenvironment and thereby enhance CAR-T cell activity. Following pulmonary delivery, the nanovesicles rapidly accumulate in the lung and selectively deliver STING agonists to PD-L1-overexpressing cells via the PD-1/PD-L1 interaction. This targeted delivery effectively avoids the systemic inflammation and poor cellular uptake that plague free STING agonists. Internalized STING agonists trigger STING signaling and induce interferon responses, which diminish immunosuppressive cell populations such as myeloid-derived suppressor cells in the tumor microenvironment and promote CAR-T cell infiltration. Importantly, the anti-PD-L1 single chain variable fragment on the nanovesicle surface blocks PD-L1 upregulation induced by STING agonists and prevents CAR-T cell exhaustion. In both orthotopic lung cancer and lung metastasis model, combined therapy with CAR-T cells and aPD-L1 NVs@cGAMP potently inhibits tumor growth and prevents recurrence. Therefore, aPD-L1 NVs@cGAMP is expected to serve as an effective CAR-T cell enhancer to improve the efficacy of CAR-T cells against solid tumors.
摘要
嵌合抗原受体T细胞(CAR-T)被免疫抑制性肿瘤微环境抑制仍然是其对实体瘤疗效的主要障碍。为了解决这一问题,我们开发了一种表达抗PD-L1的纳米囊泡,其内装载STING激动剂cGAMP(aPD-L1 NVs@cGAMP),以重塑肿瘤微环境,从而增强CAR-T细胞活性。通过肺部给药后,纳米囊泡迅速在肺部积累,并通过PD-1/PD-L1相互作用将STING激动剂选择性地递送至PD-L1过表达细胞。这种靶向递送有效避免了自由STING激动剂所面临的全身性炎症和细胞摄取不良的问题。内化的STING激动剂触发STING信号传导,并诱导干扰素反应,这减少了肿瘤微环境中的免疫抑制细胞群体,如髓系来源的抑制细胞,并促进CAR-T细胞浸润。重要的是,纳米囊泡表面的抗PD-L1单链可变片段阻断了STING激动剂诱导的PD-L1上调,并防止CAR-T细胞耗竭。在原位肺癌和肺转移模型中,CAR-T细胞与aPD-L1 NVs@cGAMP的联合治疗能有效抑制肿瘤生长并防止复发。因此,aPD-L1 NVs@cGAMP有望作为一种有效的CAR-T细胞增强剂,提高CAR-T细胞对实体瘤的疗效。
内容总结
研究背景
CAR-T细胞疗法在治疗血液恶性肿瘤方面取得了巨大成功,但在实体瘤治疗中效果有限,主要因为肿瘤微环境(TME)的免疫抑制作用。
为了克服这一限制,研究者开发了一种表达抗PD-L1的纳米囊泡,内含STING激动剂cGAMP(aPD-L1 NVs@cGAMP),旨在重塑肿瘤微环境,增强CAR-T细胞的活性。
研究方法
CAR-T细胞的制备与表征
研究者构建了针对间皮素(MSLN)的CAR-T细胞,并通过荧光显微镜和流式细胞术验证了CAR蛋白的表达效率。
通过共培养CAR-T细胞与肿瘤细胞,评估了CAR-T细胞对肿瘤细胞的特异性细胞毒性。
aPD-L1 NVs@cGAMP的制备与表征
利用基因工程改造的293T细胞系,使其表达抗PD-L1单链可变片段(scFv)。
通过细胞膜提取和挤出法制备了aPD-L1 NVs,并通过透射电子显微镜(TEM)、动态光散射(DLS)和西方印迹等技术对其进行了表征。
评估了aPD-L1 NVs对PD-L1的阻断效果和靶向能力。
体外生物活性评估
通过共培养CAR-T细胞、树突状细胞(DCs)和LLC-MSLN细胞,评估了aPD-L1 NVs@cGAMP对IFN-β等细胞因子分泌的影响。
评估了aPD-L1 NVs@cGAMP对CAR-T细胞增殖和肿瘤细胞杀伤能力的影响。
体内生物分布和肿瘤微环境重塑
通过雾化和尾静脉注射的方式,评估了aPD-L1 NVs@cGAMP在小鼠体内的分布情况。
利用qPCR和流式细胞术分析了aPD-L1 NVs@cGAMP对肿瘤微环境中炎症标志物和免疫细胞亚群的影响。
体内抗肿瘤效果评估
在LLC-MSLN原位肺癌和B16-MSLN肺转移小鼠模型中,评估了aPD-L1 NVs@cGAMP单独或与CAR-T细胞联合治疗对肿瘤生长的抑制效果。
通过IVIS成像系统监测肿瘤生长,并进行了生存率分析。
实验结果
CAR-T细胞的制备与表征
成功构建了MSLN特异性的CAR-T细胞,流式细胞术显示CAR蛋白表达效率约为64%。
CAR-T细胞在体外对LLC-MSLN和B16-MSLN细胞表现出剂量依赖性的细胞毒性。
aPD-L1 NVs@cGAMP的制备与表征
成功制备了aPD-L1 NVs,其尺寸均一,zeta电位约为-20 mV。
aPD-L1 NVs能够有效阻断PD-L1,并且具有靶向PD-L1高表达细胞的能力。
体外生物活性评估
aPD-L1 NVs@cGAMP显著提高了IFN-β等细胞因子的分泌,且仅需2%的STING激动剂剂量即可达到与自由STING激动剂相似的效果。
aPD-L1 NVs@cGAMP处理的CAR-T细胞增殖能力提高了3倍,肿瘤细胞杀伤能力提高了2.3倍。
体内生物分布和肿瘤微环境重塑
雾化给药后,aPD-L1 NVs@cGAMP在肺部的生物荧光强度是静脉注射组的5.5倍,显示出良好的肺部靶向性。
aPD-L1 NVs@cGAMP能够显著上调肿瘤组织中IFN-β、CXCL9和CXCL10的表达,同时降低PD-L1的表达。
体内抗肿瘤效果评估
在原位肺癌和肺转移模型中,aPD-L1 NVs@cGAMP联合CAR-T细胞治疗显著抑制了肿瘤生长,提高了小鼠的生存率。
联合治疗组的小鼠在50天内100%存活,而其他组的小鼠均在35天内死亡。
结论
aPD-L1 NVs@cGAMP作为一种新型的纳米载体,能够有效重塑肿瘤微环境,增强CAR-T细胞对实体瘤的疗效。这种联合治疗策略不仅提高了CAR-T细胞的活性,还显著改善了小鼠的生存率,为CAR-T细胞疗法在实体瘤治疗中的应用提供了新的思路。
图文摘要
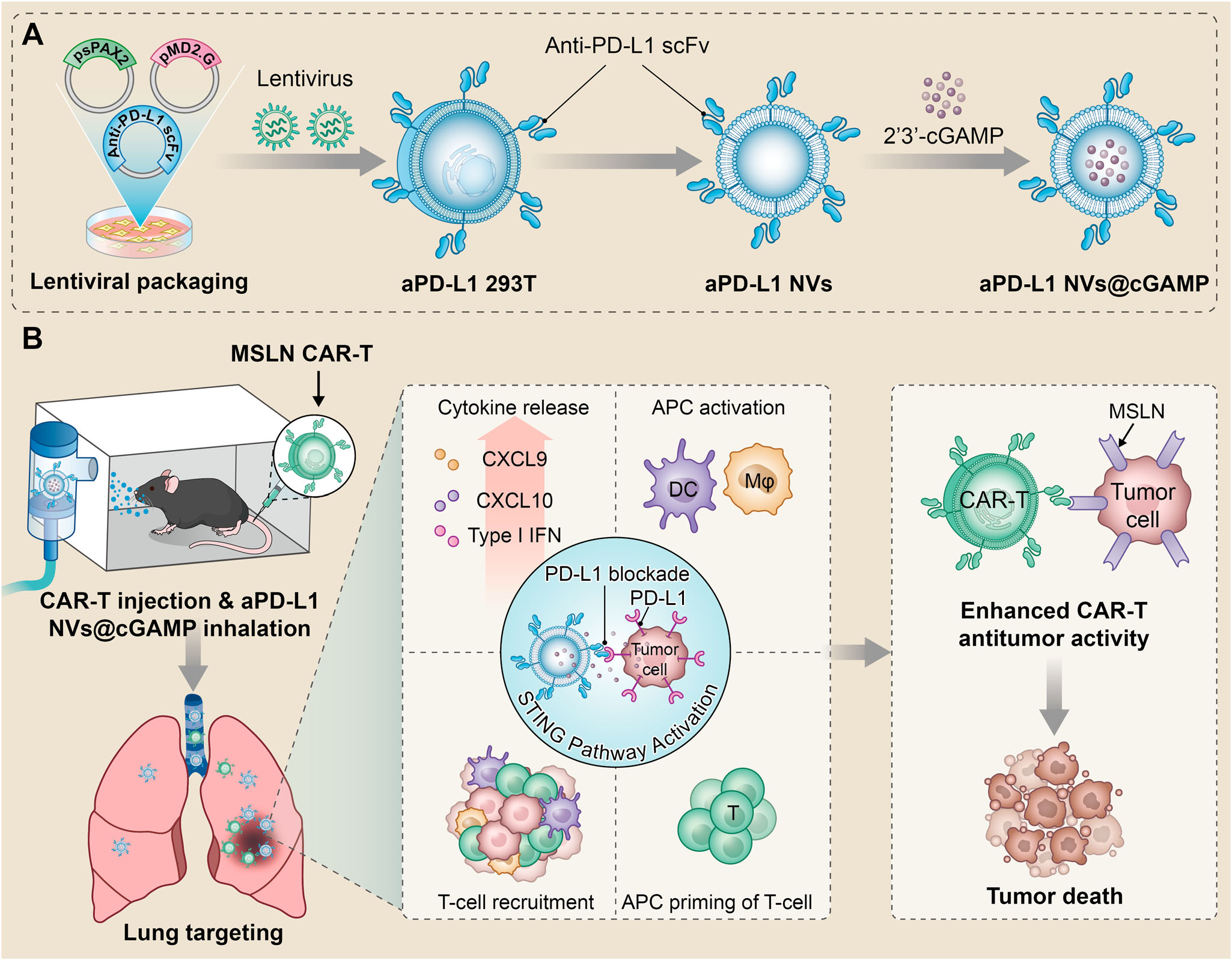
图1|aPD-L1NVs@cGAMP增强CAR-T细胞抗肿瘤效果的示意图
A 展示aPD-L1NVs@cGAMP的制备过程的示意图。
B 展示aPD-L1NVs@cGAMP增强CAR-T细胞抗肿瘤效果的机制。吸入的aPD-L1NVs@cGAMP迅速在肺组织中聚集,并通过PD-1/PD-L1相互作用将STING激动剂递送至肿瘤组织中PD-L1高表达的细胞。内化的STING激动剂通过激活STING通路,将抑制性炎症肿瘤微环境转变为促炎性肿瘤微环境,从而增强CAR-T细胞的抗肿瘤效果。此外,aPD-L1NVs@cGAMP还能有效防止CAR-T细胞耗竭,通过阻断PD-L1实现。
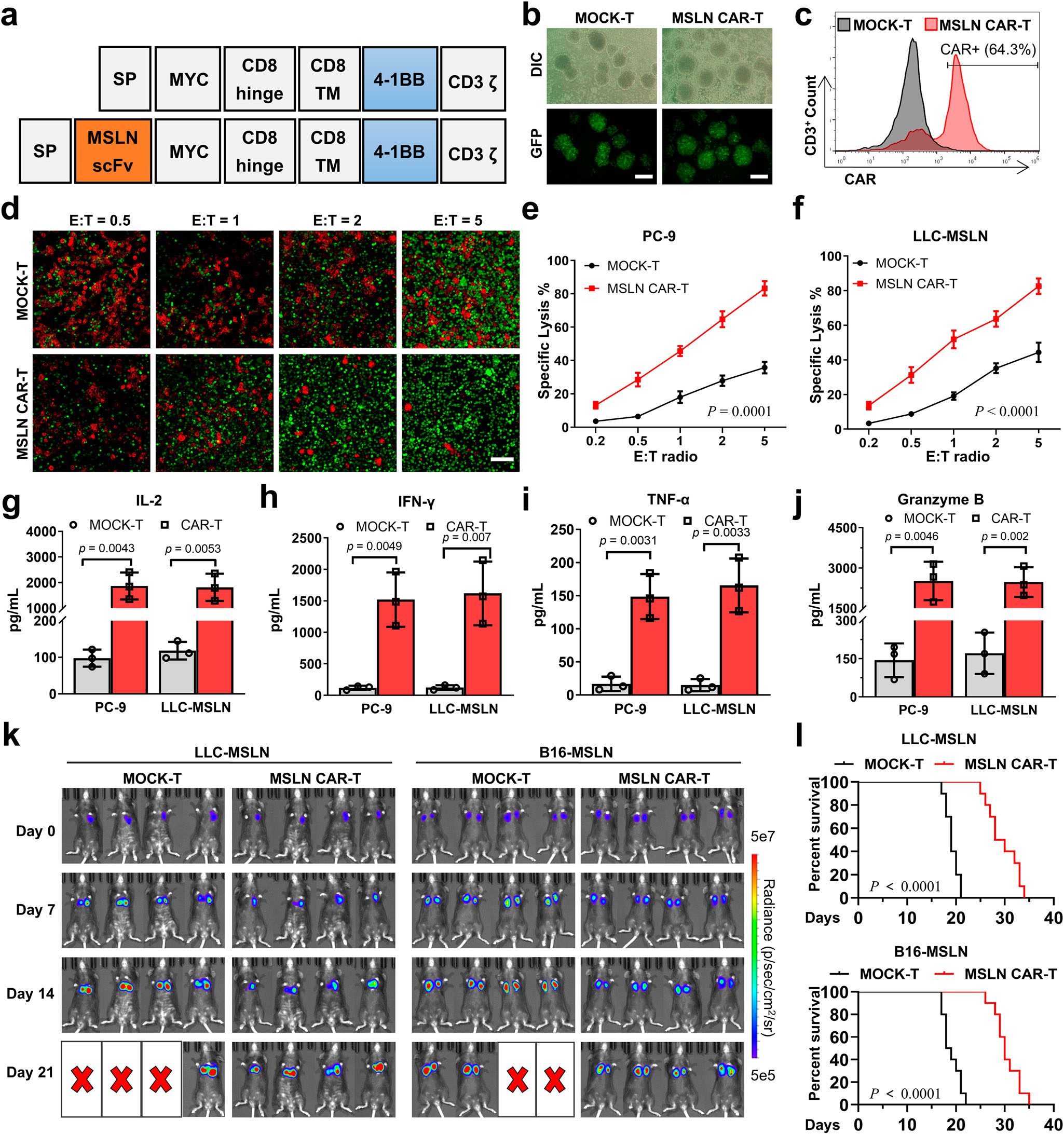
图2|MSLNCAR-T细胞的制备与特性
a MOCK-T和MSLNCAR-T细胞的分子结构。
b 通过倒置荧光显微镜观察慢病毒转导T细胞的效率。比例尺:200μm。DIC:差分干涉对比;GFP:绿色荧光蛋白。
c 通过流式细胞术检测T细胞表面CAR蛋白的表达效率。
d 将CAR-T细胞(绿色)与PC-9细胞(红色)以不同效应器-靶标比例(0.5、1、2和5)共培养24小时后,使用倒置荧光显微镜观察CAR-T细胞对PC-9细胞的杀伤效果。比例尺:100μm。
e,f 通过乳酸脱氢酶(LDH)测定法测定CAR-T细胞与PC-9细胞和LLC-MSLN细胞共培养24小时后,CAR-T细胞对PC-9细胞(e)和LLC-MSLN细胞(f)的裂解率(n=3个独立实验)。
g–j 通过ELISA测定CAR-T细胞与PC-9或LLC-MSLN细胞共培养后上清液中肿瘤坏死因子-α(TNF-α)、白介素-2(IL-2)、干扰素-γ(IFN-γ)和颗粒酶B的水平(n=3个独立实验)。
k 使用IVIS成像系统评估MSLNCAR-T细胞对LLC-MSLN和B16-MSLN肿瘤荷载小鼠的抗肿瘤效果,在向肿瘤荷载小鼠注射MOCK-T细胞或MSLNCAR-T细胞后进行检测(n=4只小鼠)。
l LLC-MSLN和B16-MSLN肿瘤荷载小鼠在注射MOCK-T细胞或MSLNCAR-T细胞后的生存曲线(n=10只小鼠)。
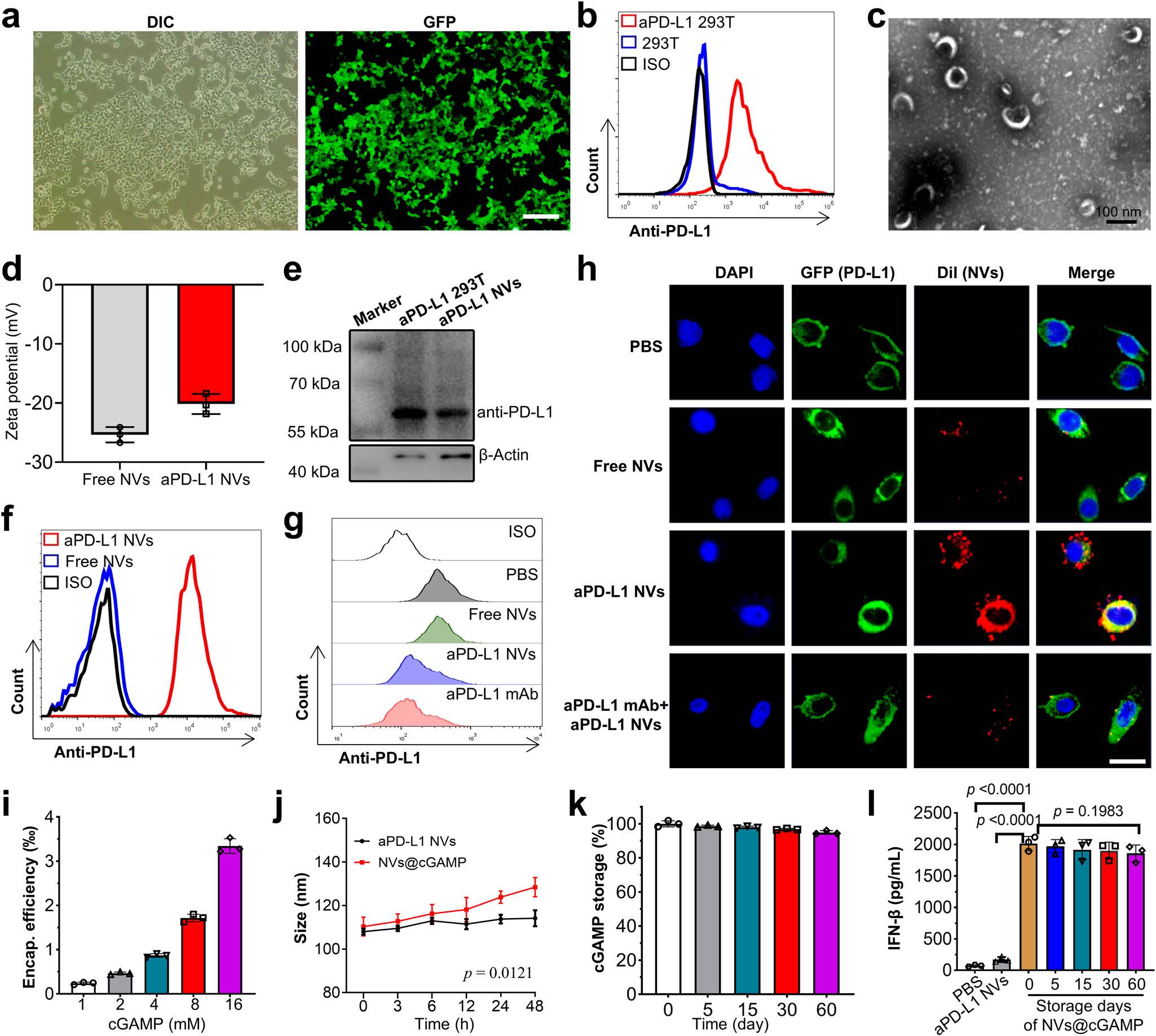
图3|aPD-L1NVs@cGAMP的制备与特性
a 通过倒置荧光显微镜观察稳定表达抗PD-L1scFv的293T细胞。比例尺:200μm。DIC:差分干涉对比;GFP:绿色荧光蛋白。
b 通过流式细胞术检测抗PD-L1scFv在aPD-L1293T细胞上的表达。
c 通过透射电子显微镜检测aPD-L1NVs的形态和大小。
d 通过纳米颗粒追踪分析(NTA)检测aPD-L1NVs的zeta电位(n=3个独立实验)。
e 通过西方印迹分析检测aPD-L1293T细胞和aPD-L1NVs中抗PD-L1scFv蛋白的表达。实验独立重复两次,结果相似。
f 通过流式细胞术检测aPD-L1NVs上抗PD-L1scFv的表达。
g 通过流式细胞术检测PC-9细胞表面PD-L1的阻断效果,将PC-9细胞与PBS、空白NVs、aPD-L1NVs或抗PD-L1单克隆抗体共孵育后进行检测。
h 通过共聚焦显微镜检测DiI标记的空白NVs和aPD-L1NVs在GFP-PD-L1PC-9细胞上的积累情况。比例尺:50μm。
i aPD-L1NVs对2'3’-cGAMP的包封效率(n=3个独立实验)。
j 在室温下储存时,aPD-L1NVs@cGAMP的粒径变化曲线(n=3个独立实验)。
k 在-80°C储存时,aPD-L1NVs@cGAMP中2'3’-cGAMP的泄漏率(n=3个独立实验)。
l 将不同储存时间的aPD-L1NVs@cGAMP用于处理树突状细胞(DCs)后,检测其诱导DCs分泌IFN-β的效率。用PBS和空白NVs处理的DCs作为阴性对照(n=3个独立实验)。
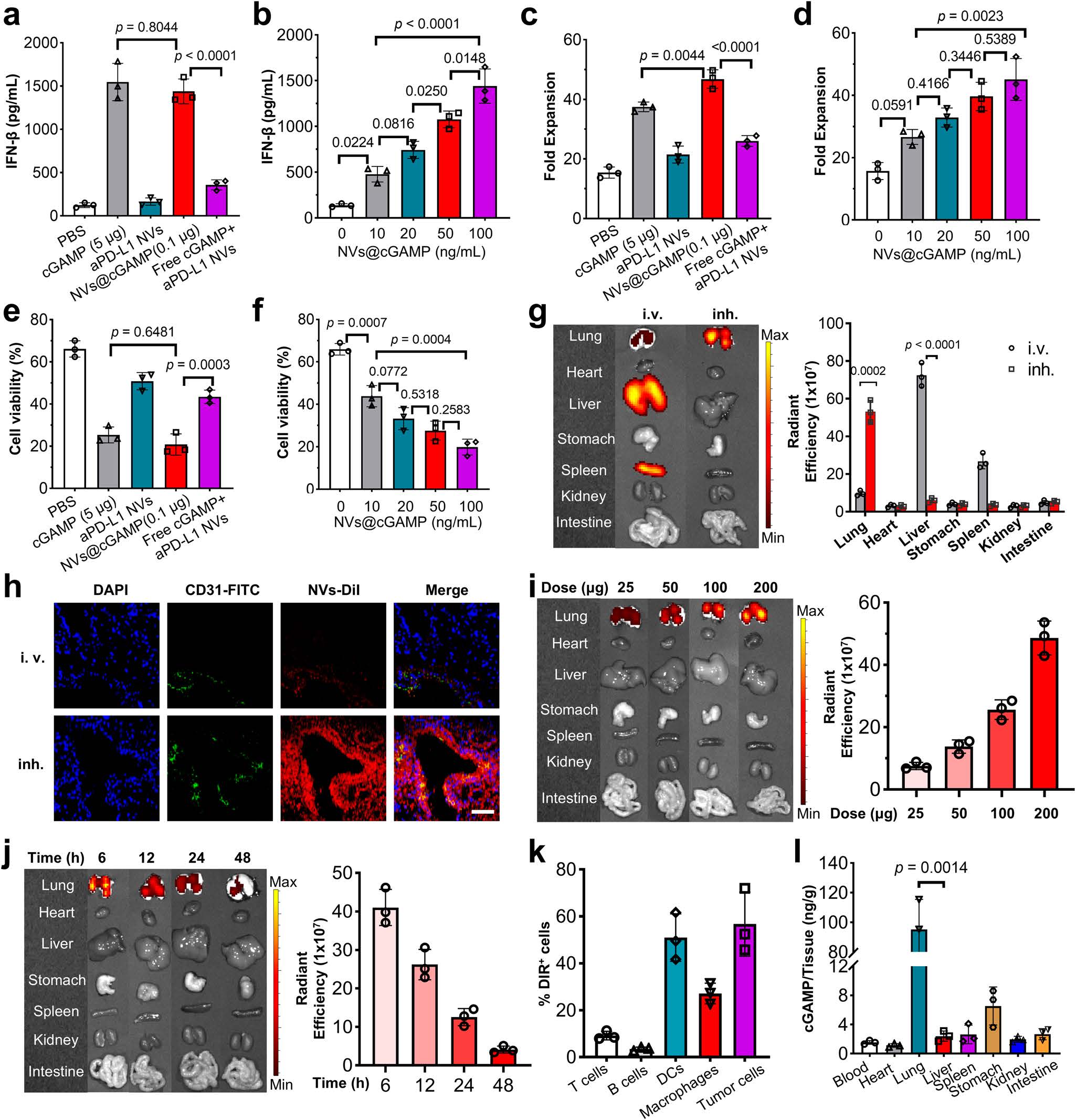
图4|aPD-L1NVs@cGAMP的体外生物活性和生物分布
a,b 在将各种药物(a)或不同剂量的aPD-L1NVs@cGAMP(b)加入CAR-T细胞、DCs和LLC-MSLN细胞的共培养体系后12小时,测定上清液中的IFN-β水平(n=3个独立实验)。
c,d 在将各种药物(c)或不同剂量的aPD-L1NVs@cGAMP(d)加入CAR-T细胞、DCs和LLC-MSLN细胞的共培养体系后5天,检测CAR-T细胞的增殖倍数(n=3个独立实验)。
e,f 在将不同试剂(e)或不同剂量的aPD-L1NVs@cGAMP(f)加入CAR-T细胞、DCs和LLC-MSLN细胞的共培养体系后12小时,评估CAR-T细胞的肿瘤细胞杀伤能力(n=3个独立实验)。
g 在通过静脉注射或吸入给药后6小时,通过IVIS成像观察DiI标记的aPD-L1NVs@cGAMP在小鼠各器官的生物分布(n=3只小鼠)。
h 从静脉注射或吸入DiI标记的aPD-L1NVs@cGAMP后6小时收集的小鼠肺组织切片的免疫荧光染色图像。比例尺:100μm。实验独立重复三次,结果相似。
i,j 在吸入不同剂量(i)或不同时间点(j)后,进一步分析aPD-L1NVs@cGAMP在主要器官中的生物分布(n=3只小鼠)。
k 在吸入后6小时,通过流式细胞术分析肿瘤微环境中的各种细胞对DiI标记的aPD-L1NVs@cGAMP的摄取情况(n=3只小鼠)。
l 在吸入aPD-L1NVs@cGAMP后6小时,检测不同器官中2'3’-cGAMP的积累情况(n=3只小鼠)。
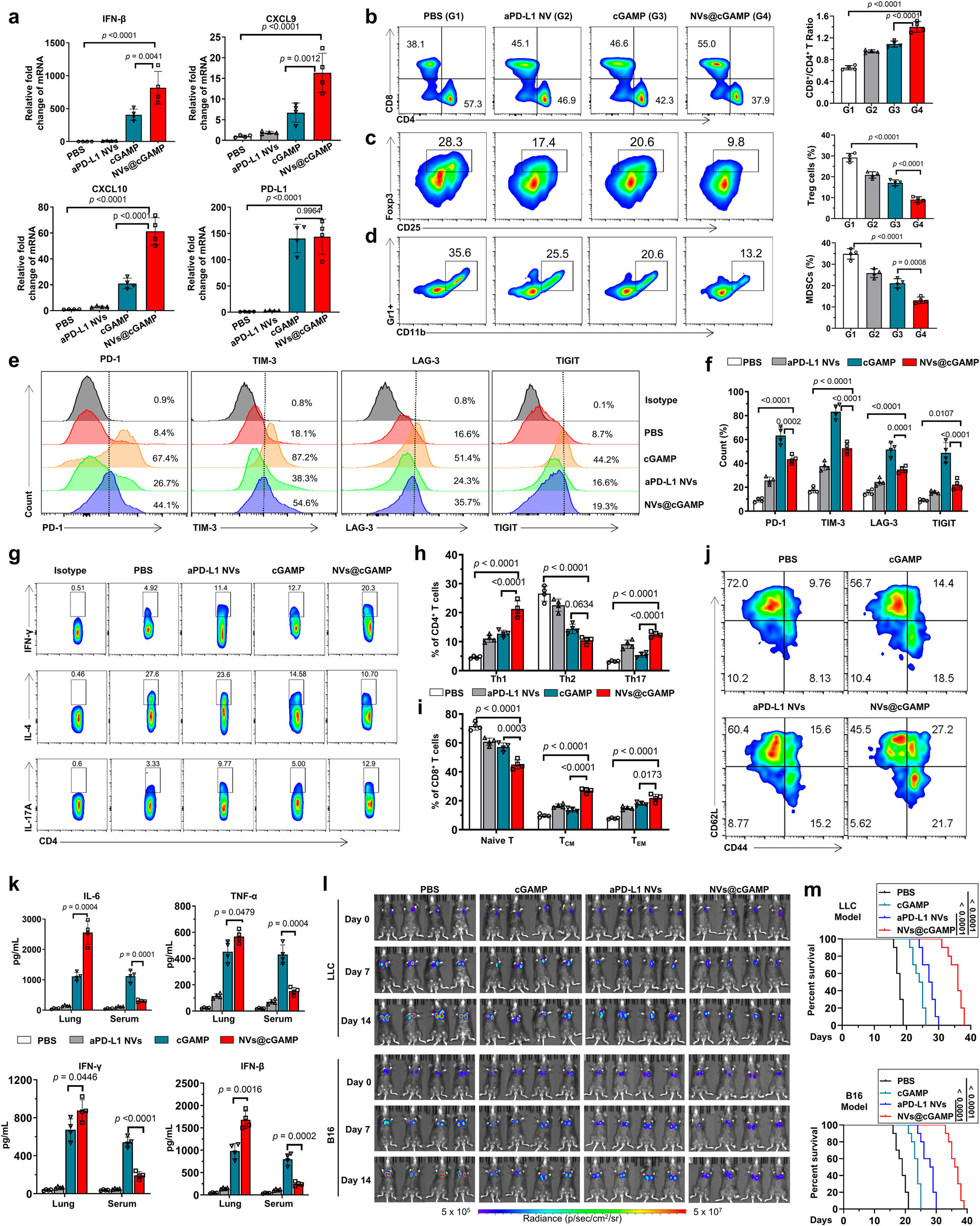
图5|aPD-L1NVs@cGAMP对肿瘤微环境的改造和抑制肿瘤生长的效果
a 通过qPCR检测不同处理后LLC-MSLN肿瘤荷载小鼠肿瘤组织中IFN-β、CXCL9、CXCL10和PD-L1基因表达水平的变化(n=4只小鼠)。
b–d 通过流式细胞术检测各治疗组肿瘤微环境中(b)CD8⁺/CD4⁺T细胞比例、(c)Treg细胞和(d)MDSCs比例的代表性流式细胞术图和统计分析(n=4只小鼠)。
e,f 通过流式细胞术检测各治疗组T细胞表面T细胞耗竭标志物(PD-1、TIM-3、LAG-3、TIGIT)的代表性流式细胞术图和统计分析(n=4只小鼠)。
g,h 通过流式细胞术检测各治疗组肿瘤微环境中Th1、Th2和Th17细胞的代表性流式细胞术图和统计分析(n=4只小鼠)。
i,j 通过流式细胞术检测各治疗组肿瘤微环境中幼稚T细胞、中央记忆T细胞(TCM)和效应记忆T细胞(TEM)的代表性流式细胞术图和统计分析(n=4只小鼠)。
k 小鼠在吸入不同药物后,其肺组织和血清中IL-6、TNF-α、IFN-γ和IFN-β的浓度(n=4只小鼠)。
l 通过IVIS系统检测不同药物处理后肿瘤生长的生物发光强度。
m不同药物处理后肿瘤荷载小鼠的生存曲线(n=10只小鼠)。
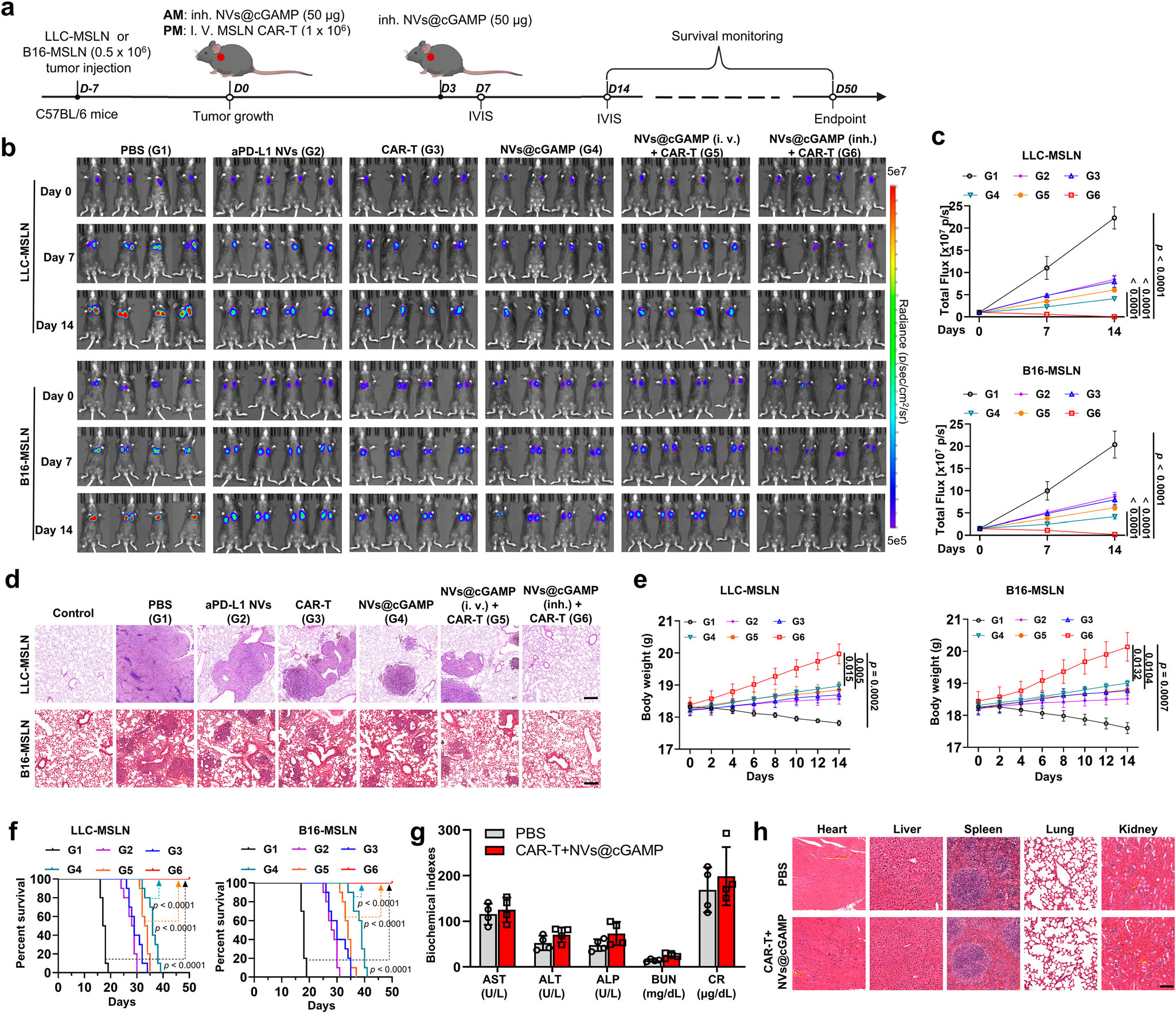
图6|aPD-L1NVs@cGAMP增强CAR-T细胞抗肿瘤能力的效果
a 展示aPD-L1NVs@cGAMP增强CAR-T细胞抗肿瘤能力的示意图。i.v.:静脉注射;inh.:吸入;IVIS:体内成像系统;AM:上午;PM:下午。
b,c 通过IVIS系统测量不同治疗组小鼠的生物发光强度,并对生物发光强度进行统计分析(n=4只小鼠)。
d 不同治疗组LLC-MSLN和B16-MSLN肿瘤荷载小鼠的代表性H&E染色切片图像(n=4只小鼠)。
e 在两种肿瘤模型中,接受不同治疗的小鼠体重变化曲线(n=4只小鼠)。
f 在两种肿瘤模型中,接受不同治疗的小鼠的生存曲线(n=10只小鼠)。
g 接受PBS或CAR-T细胞与aPD-L1NVs@cGAMP联合治疗的小鼠血清生化指标(n=4只小鼠)。
h 接受PBS或CAR-T细胞与aPD-L1NVs@cGAMP联合治疗的小鼠主要器官的代表性肺部图像和H&E染色切片。比例尺:100μm。
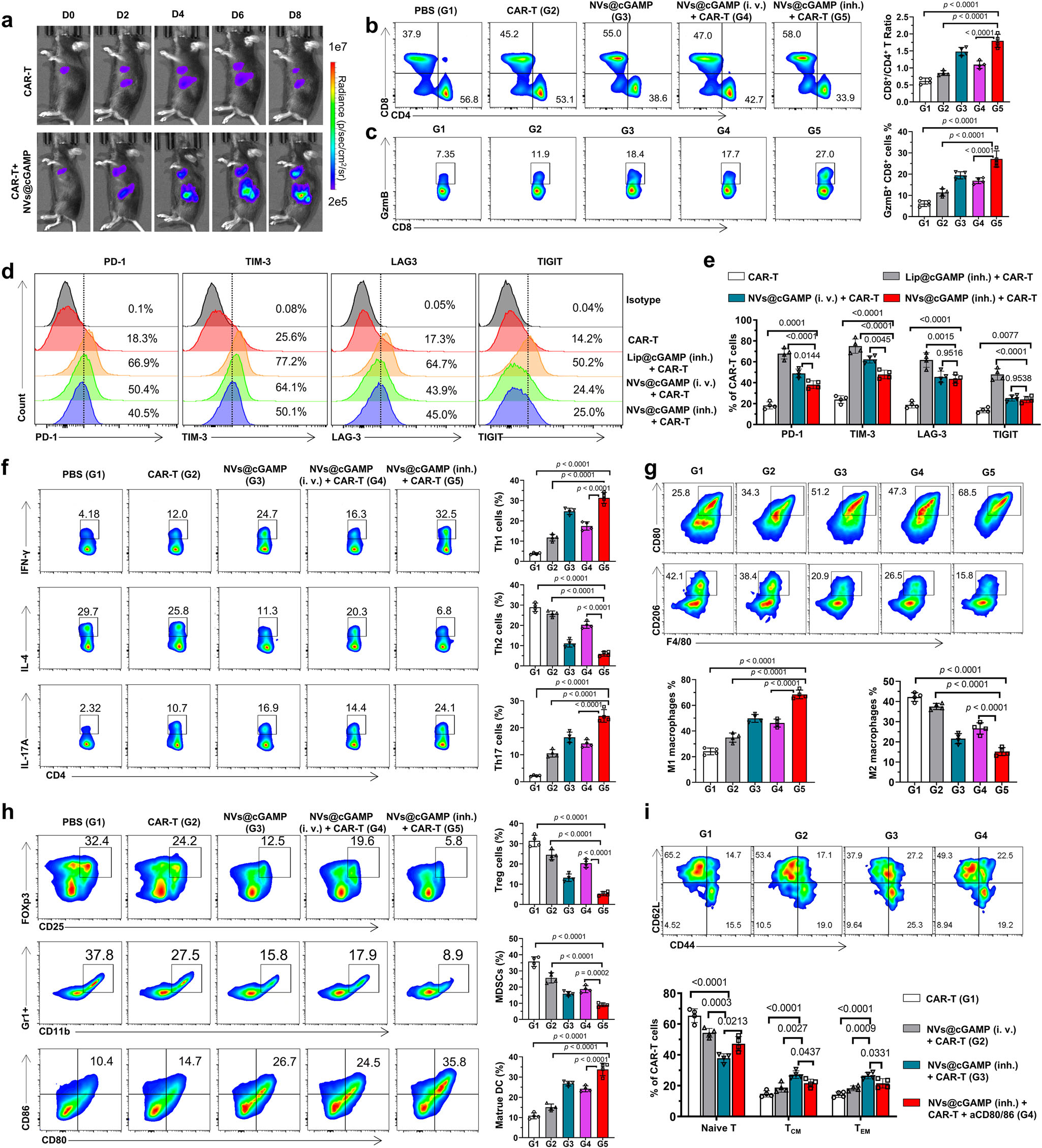
图7|CAR-T+NVs@cGAMP治疗后肿瘤微环境的变化
a 通过IVIS检测不同治疗组中表达荧光素酶的CAR-T细胞在不同时间点的生物发光强度,以评估CAR-T细胞的增殖情况。
b,c 通过流式细胞术检测各治疗组肿瘤微环境中(b)CD8⁺T细胞和CD4⁺T细胞以及(c)表达颗粒酶B的CD8⁺T细胞的代表性流式细胞术图和统计分析(n=4只小鼠)。
d,e 通过流式细胞术检测各治疗组CAR-T细胞表面T细胞耗竭标志物(PD-1、TIM-3、LAG-3、TIGIT)的代表性流式细胞术图和统计分析(n=4只小鼠)。
f 通过流式细胞术检测各治疗组肿瘤微环境中Th1、Th2和Th17细胞的代表性流式细胞术图和统计分析(n=4只小鼠)。
g 通过流式细胞术检测各治疗组肿瘤微环境中M1型和M2型巨噬细胞的代表性流式细胞术图和统计分析(n=4只小鼠)。
h 通过流式细胞术检测各治疗组肿瘤微环境中Tregs、MDSCs和成熟DCs的代表性流式细胞术图和统计分析(n=4只小鼠)。
i 通过流式细胞术检测各治疗组肿瘤微环境中CAR-T细胞群中幼稚T细胞、中央记忆T细胞(TCM)和效应记忆T细胞(TEM)的代表性流式细胞术图和统计分析(n=4只小鼠)。
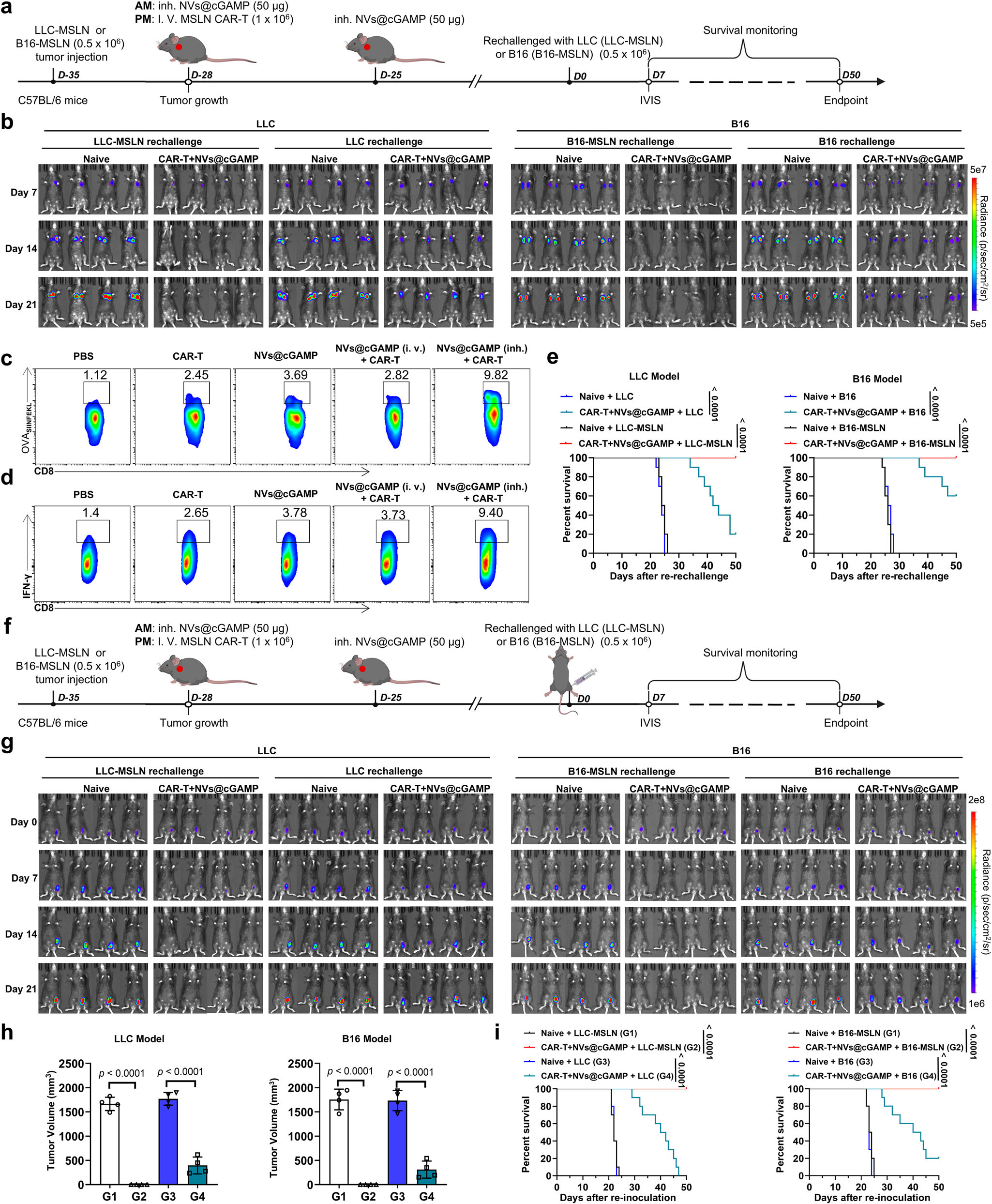
图8|CAR-T细胞与NVs@cGAMP联合治疗对肿瘤复发的抑制效果
a 评估MSLNCAR-T细胞与NVs@cGAMP联合治疗在LLC-MSLN和B16-MSLN肿瘤荷载小鼠中抗复发效果的实验设计示意图。
b 对经过联合治疗治愈的小鼠和未经治疗的天真小鼠进行再挑战,通过IVIS系统评估肿瘤复发情况(n=4只小鼠)。
c 在LLC-MSLN-OVA肿瘤荷载小鼠中,通过流式细胞术检测脾脏中OVA(SIINFEKL)特异性CD8⁺T细胞的频率。
d 在用OVA肽刺激后,通过流式细胞术评估产生IFN-γ的CD8⁺T细胞的频率。
e 经联合治疗治愈的天真小鼠和治愈小鼠在通过尾静脉再接种亲本(LLC或B16)或MSLN表达肿瘤细胞(LLC-MSLN或B16-MSLN)后的生存曲线(n=10只小鼠)。
f 展示评估对异位肿瘤复发抵抗性的示意图。
g 对治愈小鼠和未经治疗的天真小鼠进行腹股沟皮下再接种肿瘤细胞,通过IVIS成像跟踪肿瘤复发情况(n=4只小鼠)。
h 通过皮下再挑战LLC或LLC-MSLN细胞(LLC模型)以及B16或B16-MSLN细胞(B16模型)后测量肿瘤体积(n=4只小鼠)。
i 在两种肿瘤模型中,经皮下接种亲本肿瘤细胞(LLC或B16)或其MSLN表达对应物(LLC-MSLN或B16-MSLN)的天真小鼠和经联合治疗治愈的小鼠的生存曲线(n=10只小鼠)。
参考文献:
Luyang, H., Zeng, F., Lei, Y. et al. Bidirectional role of neutrophils in tumor development. Mol Cancer 24, 22 (2025). https://doi.org/10.1186/s12943-025-02228-7