CUSTOMER
客户中心
助力生命健康领域从基础研究到产业化的加速转化
纵观流式细胞术发展史,流式细胞术的发明、改进以及其在当今众多应用领域的拓展,无不得益于单克隆抗体技术、免疫标记技术和定量荧光细胞化学的大量研发和应用。流式细胞术的发展又极大地促进了这些技术在当今生命科学研究中的应用,尤其是通过流式细胞术,利用单克隆抗体进行靶标的鉴定和分析已在基础科学研究和临床实践中得到广泛的应用。根据在流式细胞术的实际工作中经常出现的问题,在此介绍抗原抗体反应的基本特点与影响因素、流式抗体的选择、流式样品的制备与染色方法。
抗原抗体反应的基本特点与影响因素
1. 抗原抗体反应的基本特点
(1)抗原抗体结合具有特异性 抗原与抗体的结合具有高度特异性,即一种抗原分子只能与由它刺激所产生的抗体结合。抗原的特异性取决于抗原决定簇的数目、性质和空间构型,而抗体的特异性取决于抗体IgFab段可变区与相应抗原决定簇的结合能力。抗原与抗体不是通过共价键结合,而是通过很弱的短距引力结合,如范德华引力、静电引力、氢键和疏水性作用等。通常当pH值和离子强度在生理条件下时,这些引力是最大的。pH值低于4.0或高于10.5时,这些引力非常弱,以至抗原抗体复合物解离。
(2)抗原与抗体的结合是可逆的化学反应 抗原与抗体的结合有高度特异性,这种结合虽具有相当的稳定性,但为可逆反应。抗原与抗体为非共价键结合,不形成稳定的共价键,因此在一定的条件下会解离。抗原抗体反应实质上是一个不断结合与不断解离的平衡过程,所以通常在标记完成后,若不能尽快进行检测,建议用适当的固定液进行固定,如4%多聚甲醛溶液。
2. 抗原抗体反应的影响因素
(1)电解质 抗原与抗体一般为蛋白质,它们在溶液中都具有胶体的性质,当溶液的pH值大于它们的等电点时(例如在中性和弱碱性的水溶液中),它们大多表现为亲水性,且带有一定的负电荷。抗原和特异性抗体有相对应的极性基团,两者的特异性结合也就是这些极性基团的相互吸引。抗原与抗体结合后就由亲水性变为疏水性,此时易受到电解质的影响。因此,通常应用0.85%的生理盐水和pH值为7.2~7.4的磷酸盐缓冲液作为抗原、抗体的稀释液,以维持适当的电解质浓度。
(2)反应温度与时间 当抗原与抗体在较高温度中反应时,由于抗原、抗体碰撞的机会增多,其反应速度快。但温度过高(56℃以上)时,抗原或抗体将变性或被破坏。大多数实验室在室温环境(25℃左右)中进行免疫荧光染色,适当振摇,可加快两者的反应速度;也有学者认为在4℃冰浴下反应更好。反应时间也是抗原抗体反应必要的条件之一,时间越短,结合越不完全。反应时间一般以30~60min为宜。但值得注意的是,对于采用全血法(用全血标本进行标记,再破坏红细胞)进行检测的,由于全血标本中含有补体系统,抗原抗体反应会激活补体系统,导致阳性细胞溶解而影响检测结果,因而不能在37℃的恒温水浴中或室温环境中进行反应,而宜在4℃冰箱中反应,且反应时间不能太长,一般为30min左右。时间太长(超过1h),也会引起阳性细胞溶解,故实验者一定要严格控制反应时间。
流式细胞术抗体的选择与组合原则
荧光抗体选择与组合的好坏直接影响流式结果的准确性。其选择与组合的总原则为根据机型选配合适的抗体,抗体的选择宜符合“高低搭配”原则。其原则有以下几点。
1. 尽量使用直接标记抗体
直接标记抗体是用荧光素标记的单克隆抗体或多克隆抗体,一步染色,操作方便,影响因素少,结果准确。
2. 注意流式抗体的应用级别
美国食品药品监督管理局(FDA)将流式试剂分为IVD(classI in vitro diagnostic product,I类体外诊断试剂), ASR(analyte specific reagent,分析物特异性试剂)和RUO(research use only,仅用于研究)试剂三类。其中, IVD和ASR均可用于体外临床诊断,而RUO试剂只能用于科学研究,不能用于临床诊断。在我国,用于体外诊断的试剂还必须取得国家食品药品监督管理总局(SFDA)认证。
3. 抗体滴度或标记量的选择
建议根据抗体使用说明书使用抗体标记量或浓度,也可在正式实验前,根据信噪比来确定其最合适的滴度。首先将细胞的浓度固定(一般为1x105个/管),根据抗体使用说明书建议的使用浓度,选择高、中、低浓度和同型抗体对照,在相同的实验条件下进行免疫染色后检测,显示每一种滴度与同型抗体对照的直方图,统计阳性细胞与对照细胞的平均荧光强度,并计算特异性荧光信号(signal)与非特异性荧光信号(noise)的比值,即信噪比(signal-to-noise ratio, S/N值)。S/N值越大,表示阳性细胞与对照细胞的荧光峰分离越好,S/N值>3属于可接受范围。
在进行单色或多色标记时,应注意抗体的稀释度。如3种抗体单独使用时的最佳用量是20μL,而进行3色标记时,若各加20μL,则总量为60μL。对于每一种抗体来说,其浓度因为稀释而变成原来的1/3,不再是最佳用量。因此进行多色标记时应该注意控制稀释度,即各抗体用量与总反应体系之间的比例,或适当延长反应时间。
提醒:在检测流式标本时,我们经常发现如下问题:①为节省荧光抗体,不经过预实验,就按抗体说明书减半量甚至更多进行标记;②不进行细胞计数,完全凭感觉进行标记。这样操作会直接影响实验结果,因为细胞数量和抗体的标记量就像一个跷跷板的两头,当细胞数量增加、抗体量不变或细胞数量不变、抗体量不足或过量时,荧光抗体分布到每个阳性细胞上的量减少或背景过强,导致分群不明显(图1)。因此,不建议使用抗体减半量甚至更多进行标记,除非进行过预实验,并要注意进行细胞计数,使每次实验的细胞数量基本一致。

图1 荧光抗体过多或过少影响阴、阳性细胞分群
注:抗体用量为0.1~0.3 pg时,阴、阳性细胞分群明显;抗体不足或过量时,荧光抗体分布到每个阳性细胞上的量过少或背景过强,导致分群不明显。
4. 根据流式细胞仪的类型及荧光素的荧光光谱选择荧光抗体
不同类型的流式细胞仪所配备的激光器种类、数量不同,其激发波长不同,所使用的光学滤片也会有差异(图2)。如:FACSCalibur配有488nm和633nm的双激光器,可提供双波长激发光;BD LSR II可有355 nm、405 nm、488 nm和633 nm四种激光器选择,可进行10色以上的多色荧光分析。
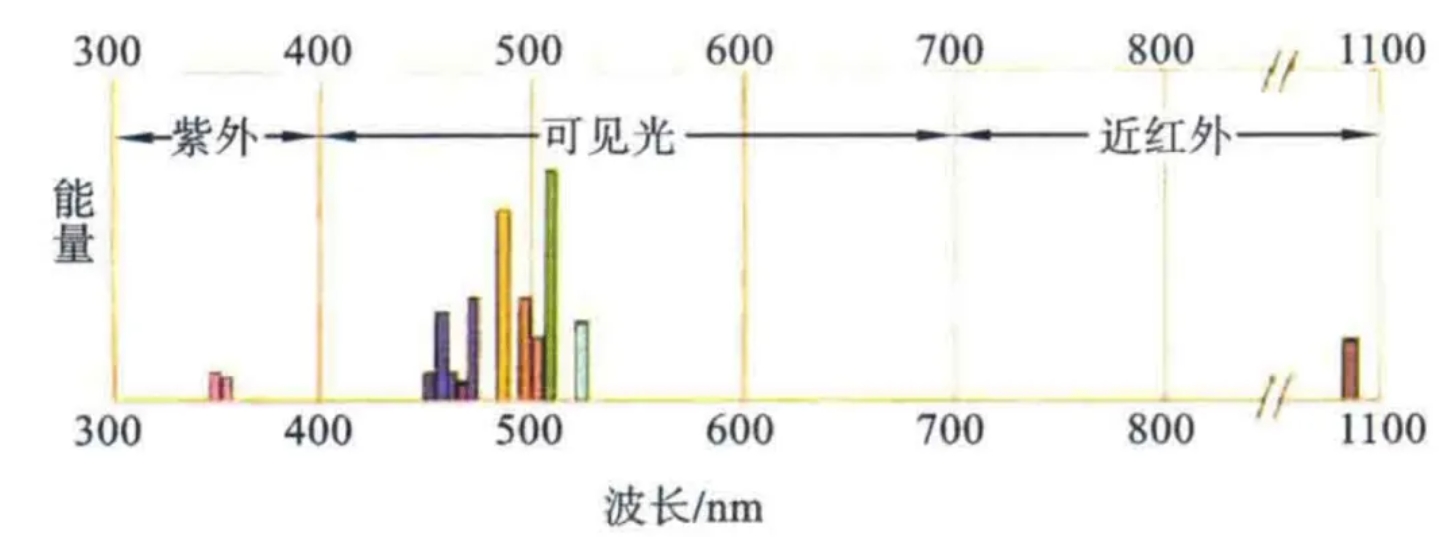
图2 激发光源与波长
各种荧光素的激发与发射波长也明显不同(图3)。在多色分析中,虽然可以通过荧光补偿来消除荧光光谱重叠的影响,但使用的荧光种类越多,补偿的复杂度与难度越大。因此应根据流式细胞仪的类型及荧光素的荧光光谱,尽量选择荧光光谱重叠少的荧光抗体组合。
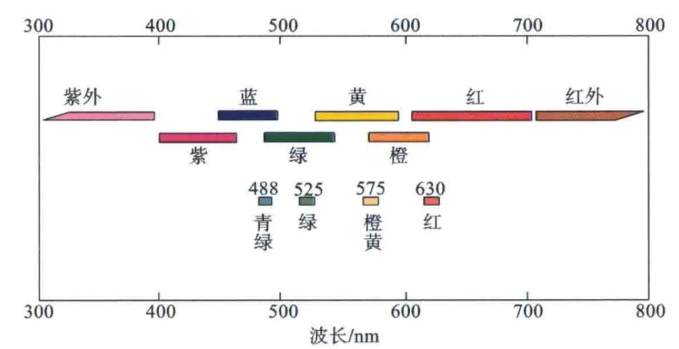
图3 光的颜色与波长
由多种荧光抗体组合在一起进行多色荧光分析越来越多地应用于科研与临床,但是并非各种抗体均能自由组合在一起应用。有些荧光标记搭配不好,会影响荧光补偿的调节。如PE-Cy5和APC,在BD流式细胞仪上,此搭配需要较大幅度地进行两者间荧光补偿的调节,甚至无法实现正确补偿。其原因为Cy5的激发波长与APC的激发波长相近,均在630 nm左右,所以PE-Cy5染料中的Cy5在进行内部能量传递(即PE的发射光激发Cy5)时,也会被激发APC的第二个激光器(氦氖激光器)所激发,导致PE-Cy5与APC间的荧光补偿很难调节。相反,PE-Cy5.5中的Cy5.5的激发波长为675nm,不能被激发APC的第二个激光器所激发,也就不存在Cy5.5对APC的干扰,荧光补偿就很小。因此建议使用PE-Cy5.5与APC进行搭配。常用激光器激发的荧光染料与其特性见附录A。
5. 根据细胞抗原分子表达水平和荧光素荧光强度选择荧光染料
(1)细胞表面抗原分子表达水平 目前已有300多种具有CD分类号和大量没有CD分类号的CD分子可供流式细胞术检测。各CD分子在细胞上的表达水平是不同的,有的CD分子在细胞上表达较多,如CD45表达高达200000个以上分子;有的则较低,如CD19仅表达18000个分子(表1)。抗原分子的表达水平决定了荧光抗体的结合量,从而影响荧光信号的强弱。根据其表达水平可将CD分子分为三类(图4):①强阳性表达:这类分子通常在细胞上高水平表达,经相应荧光抗体染色后,荧光信号强,阴、阳性峰分离明显,非常容易确定其阴、阳性,如CD45、CD3、CD4等分子。②较强阳性表达;这类分子在细胞上有较高水平表达,但通常呈连续性表达。经相应荧光抗体染色后,荧光信号较强,阴、阳性峰呈连续性,需要严格的阴性对照才能确定其阴、阳性,如CD45RO、CD27、CD28等分子。③弱阳性表达:这类分子在细胞上呈低水平表达或呈诱导性(或激活性)表达,经相应荧光抗体染色后,荧光信号较弱,阴、阳性峰不明显,需要严格的阴性对照才能确定其阴、阳性,如CD25分子等。
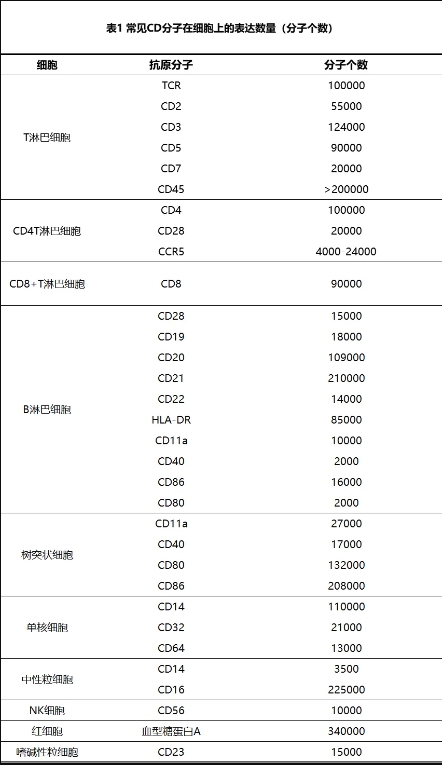

图4 三类CD分子表达情况及其在直方图上的显示情形
(2)常用荧光染料的荧光强度 荧光染料的荧光强度是有区别的。根据其染色指数与分辨率等级将常用荧光染料分为四级:非常亮(very bright)、亮(bright)、中度亮(moderate)和暗(dim)。荧光染料染色指数(stain index)=D/W,D代表荧光阴、阳性峰间距,W代表峰的宽度;而荧光染料分辨率则是经不同荧光素标记的多个同一克隆抗体在不同地点、不同型号流式细胞仪上检测所得的染色指数(图5、表2)。常用荧光染料的染色指数从高到低排列为 PE>APC>PE-Cy5.5>PE-Cy7>FITC>APC-Cy7>PerCP。
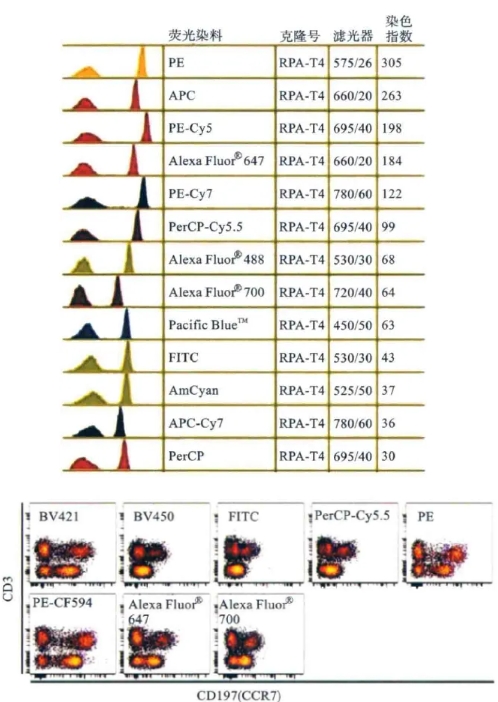
图5 常用荧光染料的染色指数与分辨率

(3)根据细胞抗原分子表达水平和荧光素荧光强度选择荧光染料的原则 根据细胞抗原分子表达水平和荧光素荧光强度选择荧光染料的总原则为"高低搭配"原则,即高表达的靶分子用低亮度荧光素,低表达的靶分子用高亮度荧光素。在用流式细胞术分析这些分子时,应结合流式细胞仪的通道,各分子的表达水平以及荧光染料荧光强度进行综合选择搭配。对于表达较多的分子,几乎可以用任何荧光素标记的抗体检测,在多色搭配时,一般可用FITC等弱荧光染料;对于表达较少的分子,则要用较高S/N值的荧光素,包括APC,PE,PE-Cy5和PE-Cy5.5等(表3)。
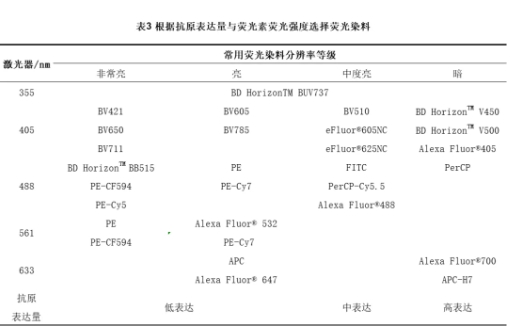
6. 参照不同公司提供的流式抗体图谱选择合适的荧光抗体
(1)针对的抗原表位不同,流式抗体的染色指数或分辨率也会不同因其针对的抗原表位不同,同一公司生产的单克隆抗体特异性不同(即克隆号不同),流式抗体的染色指数或分辨率也会不一样。即使其标记的荧光素相同,其荧光信号的强度、分布及峰形锐利程度也有较大的区别;同一克隆号,不同荧光素标记的抗体,其染色指数或分辨率也不一样。
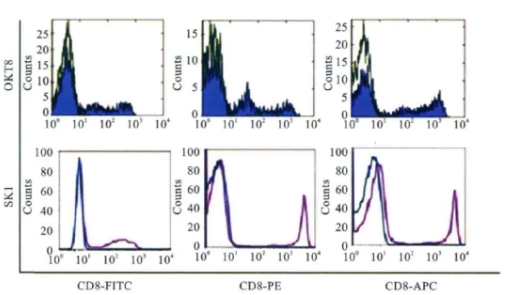
图6 同一公司生产的OKT8与SK1荧光抗体,其荧光信号有明显差别
注:①若不考虑其他因素,应选择针对CD8α的流式抗体时,应选择SK1或SK1、CD8 PE流式抗体,若需要检测CD8弱阳性表达,则应选择OKT8克隆。
(2)不同的生产工艺会影响流式抗体的染色指数或分辨率 不同公司生产的单克隆抗体因其生产工艺不同,其流式抗体对实验过程中的标本处理方式的敏感程度也不同,其染色指数或分辨率不一样(图7)。
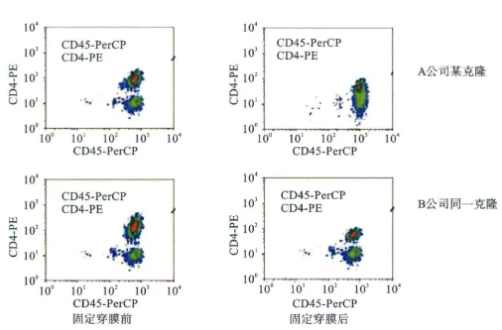
图7 不同公司生产的流式抗体固定前后的分辨率不一样
注:①尽量选择同一公司生产的配套试剂盒;②尽量选择使公司同一处理流程中或实验条件中的相同荧光抗体。