CUSTOMER
客户中心
助力生命健康领域从基础研究到产业化的加速转化
流式细胞术作为一项先进的检测技术,已广泛应用于科研与临床检验,故要对其进行质量控制,尤其是在临床检验方面。流式细胞术的质量控制包括分析前、分析中、分析后的质量控制。分析前的质量控制主要是样品采集、保存和传送以及仪器设备的校准等;分析中的质量控制主要是操作过程的控制;分析后的质量控制主要是对数据结果的处理、对结果的可信度评价等。
流式细胞术分析前的质量控制
1. 流式细胞仪的校准
流式细胞仪的校准包括液路的稳定性、光路的稳定性、多色标记荧光补偿的准确性、光电倍增管转换的线性和稳定性。流式质量控制中对仪器的校准主要是利用标准微球进行监测。该微球具有已知的固定荧光强度、大小和光散射性。
2. 样品的制备、处理与质量控制
流式样品的制备、处理与质量控制的要求是制备成单细胞悬液,尽量维持细胞结构,保护细胞的活性与抗原性。临床检验对流式样品的采集、保存、运输和制备要求严格,通常适合于研究用流式样品的质量控制。用于临床检验流式分析的样品种类很多,包括外周血、骨髓穿刺液、组织活检物、胸腹腔积液、脑脊液、内镜活检物等。每种样品都有不同的采集、保存、运输和制备要求。
①样品外观:有严重溶血、凝聚或坏死的样品应弃用。
②单细胞悬液的获取:外周血和骨髓穿刺液为天然单细胞悬液,经洗涤后可直接进行标记;活检组织则需先制备成单细胞悬液,常用的方法有机械分离法和酶消化法,不同的实验要求适用不同的方法。进行膜抗原标记时,机械法较常用。仅进行细胞周期或DNA倍体分析时,可在机械法的基础上加酶消化(如胰蛋白酶、胃蛋白酶等)。
③抗凝剂的选择:外周血标本可采用EDTA、ACD或肝素抗凝。如果用同一份血标本做白细胞计数和流式分析,则应用EDTA抗凝;进行血小板分析的实验时,一般不用肝素抗凝。骨髓穿刺液常用肝素或EDTA抗凝,通常不推荐使用ACD,因为相对大量的ACD会改变骨髓悬液的pH值,从而影响骨髓细胞活性。
④样品的保存:原则上,样品应在采集后立刻进行处理和染色。采用EDTA、ACD或肝素抗凝的样品在室温(16~25℃)环境中可保存12~72h。采用肝素抗凝的外周血或骨髓穿刺液通常可保存48~72h;EDTA抗凝的外周血和骨髓穿刺液可保存12~24h;ACD抗凝的外周血可保存72h;对于只做胞内染色的样品,可固定细胞以长期保存,具体取决于所分析的抗原特性和染色方式。
⑤去除红细胞的方法:一般用红细胞裂解法,因其操作简单、快速,并可保持原始标本的白细胞分布。最好在染色后溶血。若在染色前溶血,需确认:a. 抗原性不被溶血过程改变;b. 溶血剂可被彻底洗去,靶抗原与抗体结合的动力反应未受影响;c. 所用的溶血剂不含固定剂。密度梯度离心法对白细胞的回收和富集效果较好,同时可去除红细胞、碎片等,但应该注意,某些重要细胞群可能被选择性丢失。
⑥细胞与抗体的比例:厂家推荐的抗体用量通常是假定靶细胞数量在1x106范围内。若标本没有足够的靶细胞或靶细胞量过大,会造成正常浓度下的抗体相对过量或不足,导致假阳性或假阴性结果,因此,每个实验室应根据厂家推荐的方法调整细胞与抗体用量,得到最适的细胞/抗体比。
⑦死亡细胞:死亡细胞会影响流式结果的准确性,并对许多抗体有很强的非特异性染色。对于经过长时间运和储存的样品应注意在流式检测时加染死亡细胞染料。
3. 荧光抗体的选择与组合原则
荧光素标记的单克隆抗体是流式细胞术应用最基本的试剂,荧光抗体选择与组合的好坏直接影响结果,抗体的质量控制也是实验的关键环节。抗体的质量包括其特异度、灵敏度、精密度。
4. 流式样品的染色方法
①细胞表面(胞膜)染色:多采用全血标记法或细胞分离后进行直接免疫荧光标记法。全血标记法又分溶血前标记和溶血后标记。若红细胞或血浆成分对标记有影响,适合采用溶血后标记,但应该注意溶血剂对膜抗原的影响,溶血剂一般不应含固定剂。如免疫球蛋白轻链检测和阵发性血红蛋白尿的检测等。进行细胞表面抗原检测时应注意保持细胞膜的完整,死亡细胞会暴露胞内与表面抗原相同的抗原,从而影响检测的特异性。
②胞内染色:胞内染色的关键是使细胞膜通透,而不影响细胞骨架的完整性。该步骤既要让荧光染料透入胞膜甚至核内,还要保证固定和透膜的步骤不影响有关抗原与相应抗体的结合力和核酸与染料的结合。某些适用于胞内染色的试剂不一定适用于表面标记分析。
③胞膜和胞内染色:原则上先胞膜染色,再固定、膜通透和胞内染色,最后是DNA染色。活细胞核酸染料(如DAPI、TO、AO等)染色时不用固定或透膜。
流式细胞术分析中的质量控制
流式细胞术分析中的质量控制主要是对流式数据的获取与分析过程进行质量控制。流式细胞术数据的获取必须在仪器性能的校准均合格的基础上进行。流式细胞仪是基于对散射光信号和荧光信号进行分析的仪器,因此,仪器散射光和荧光信号的光电倍增管电压、增益、荧光补偿等参数的调校、设定直接影响结果。
1. 流式样品的设置
流式样品的设置是否合理严格、对照体系是否严格,直接关系到参数调校是否准确,影响结果评判。
2. 细胞获取数量
为了结果的可靠性,细胞获取数量越多越好。一般来说,获取的细胞数量应为10000~20000个。临床上微小残留病灶(MRD)的检测要求达到104数量级水平;干细胞移植中CD34细胞的检测应至少获取100个CD34细胞或75000个有核细胞。
3. 流式数据的分析
在流式结果报告中,通常报告细胞百分比、平均荧光强度、DNA指数(DI)等参数。对于临床检测项目来说,应遵循行业内标准、规范与要求,如艾滋病划分中外周血CD4细胞的绝对定量、干细胞移植中的CD34细胞定量、OKT3治疗监测中CD3细胞的绝对定量等,最终都以细胞浓度(个/μL)的形式表示出来。对于白血病/淋巴瘤免疫分型结果的分析,目前大多主张以文字描述抗原有无和强弱的报告方式,废弃百分比的报告形式。
流式细胞术分析中的质量控制
流式细胞术分析后的质量控制包含流式数据分析质量评价与室间质量评价。
1. 流式数据质量分析
任何一次实验都一定有误差,在一定意义上可以将误差分为实验方法学的系统误差和随机误差。流式数据的分析质量控制也必须重视检验方法学的评价,以减少或消除随机误差。要使检验结果的误差控制在可接受的低水平或者允许的误差范围内,必须使用总误差水平符合要求的检验方法(包括仪器、试剂、具体操作方法等)。在临床检验质量控制中使用较多的方法是 Levey-Jennings质控图。Beckman Coulter公司在其流式细胞仪上装备自动记录和绘制 Levey-Jennings质控图的软件。一般该质控图是测定时间(次数)与测定值的关系图(图1),图中标出横线。均值±2s为上、下警告限,均值±3s 为失控限。质控图建立后将每次质控品的测定值绘在图上。
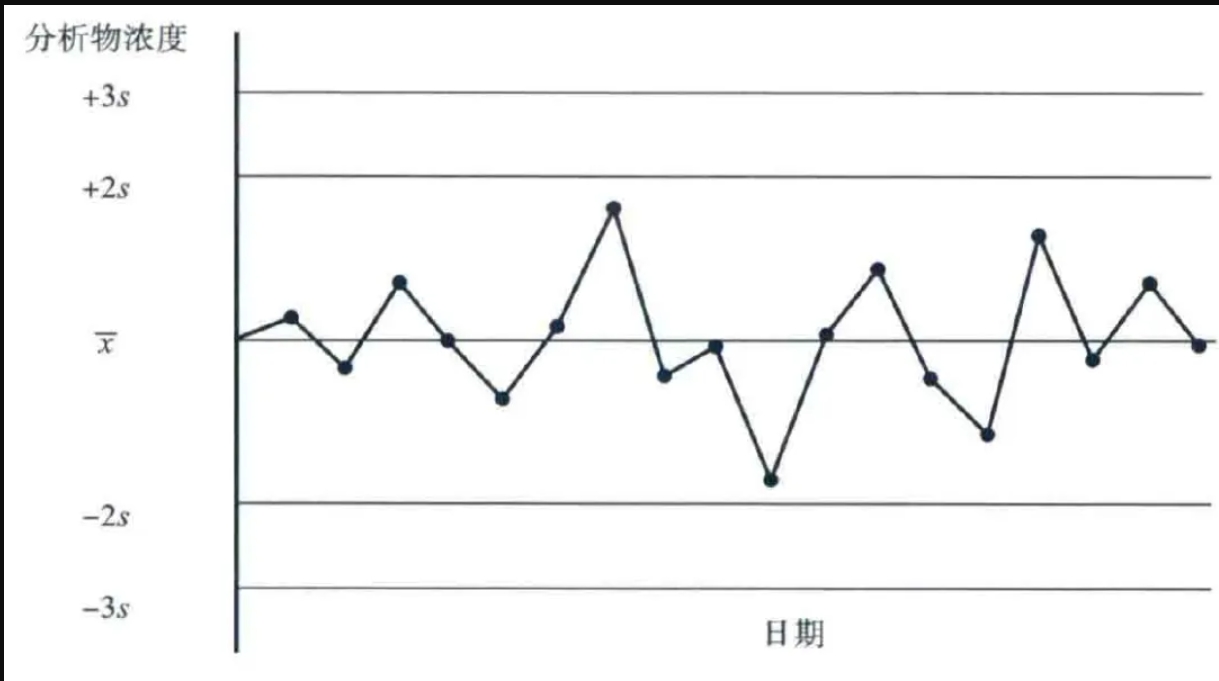
图1. levey-Jenning 质控示意图
在质控图中,按照正态分布规律,数据应有以下分布特点:①所有测定值应均匀分布于平均值两侧;②质控品测定值应有95.5%的可能性在均值±2s 范围内;③不应有连续6次以上的结果落于平均值的一侧;④不能有连续5次以上的结果有逐渐增高或降低的趋势性变化;⑤不应有连续2次的结果在均值±2s 范围之外;⑥没有1次结果在均值±3s 范围之外。如果不符合上述规律,则说明结果失控。只有证实当天质控结果在控制之内,对当天的临床检验才能发出结果。一旦出现失控,须查明原因,重新检验。对有1次检验结果超出均值±2s 范围,提示警告。同批实验中2个质控品的结果差值超过4s,也是失控规则之一,提示存在随机误差;连续4次质控结果同方向超出均值±s 范围,提示存在系统误差。
2. 室间质量评价
室间质量评价主要是控制实验室工作的不准确度,是对室内质量控制的补充。执行室间质量评价可使实验的受控项目达到一定的精密度。室间质量评价的基本路径:由专门机构定期向临床实验室分发质控品,要求各实验室检测后返回测定结果,经过整理和统计,以数据和报告形式反映各实验室间及各分析方法间的差异,根据各实验室测定结果与靶值的离散程度,计算出该实验室的分数,及时反馈给参加者,便于改进工作。我国于2005年由卫计委(原卫生部)临床检验中心开始组织开展临床流式细胞术室间质量评价。现已开展了淋巴细胞亚群检测和CD34绝对计数等10余个指标的室间质量评价。