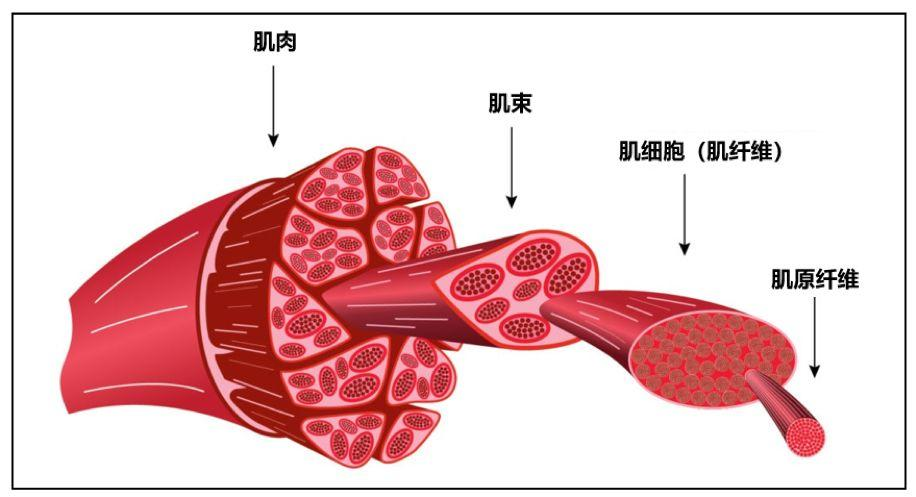
骨骼肌是一种横纹肌,通常是通过肌腱固定到骨骼上,其伸缩可以带动骨骼的移动,促进机体运动。
肌细胞呈纤维状,不分支,有明显横纹,核很多,且都位于细胞膜下方。肌细胞内有许多沿细胞长轴平行排列的丝状肌原纤维,每一肌原纤维都有相间排列的粗肌丝及细肌丝。肌纤维收缩并不是肌纤维中肌丝本身的缩短或卷曲,而是细肌丝在粗肌丝之间滑行的结果,肌丝滑行使肌节长度缩短,肌原纤维缩短表现为肌纤维收缩。
体外培养大鼠骨骼肌细胞,为临床肌肉损伤的治疗提供理论依据。
01 实验前准备
- 实验开始前,将眼科剪刀、眼科镊子、培养皿、15ml离心管、移液管、移液枪、枪头等放入无菌超净工作台,以紫外线照射30min。
- 按照含0.2%的XI胶原酶、0.2%的中性蛋白酶、0.1%的胶原酶进行配制消化液,用0.22微米的PES微孔滤膜进行过滤除菌,置于50毫升离心管中,可直接用于组织消化。瓶口消毒后室温待用。
- 取出无菌培养皿,分别作好标记,吸取适量PBS置于相应标记的培养皿中。
- 无菌条件下,准备各种大小的剪刀、止血钳、眼科镊子和手术刀。将断颈处死后浸泡于体积分数为75%乙醇的SD大鼠仰卧在超净工作台内的培养皿上。
02 骨骼肌提取
- 用剪刀剪开大鼠后肢皮肤,暴露腿部肌肉,用手术刀小心地割取后肢大腿肌肉,同样方法分离另一后肢大腿肌肉。小心剪取表面无附着膜和脂肪组织的肌肉,置于装有PBS的无菌培养皿中。
- 将剪取的骨骼肌在无菌PBS溶液中,去除脂肪组织后放置于含有消化液的培养皿中,采用眼科剪刀剪碎骨骼肌组织,成1平方毫米不规则碎片。
- 轻轻摇匀,室温静置消化30分钟。
- 收集组织悬液于50毫升离心管中,用消化液反复冲洗培养皿,直至将全部组织块收集到离心管内。
- 经吹打打匀组织块悬浮液。
- 配平离心,每分钟1000转,室温离心十分钟。
03 骨骼肌悬液制备及培养
- 离心后小心去除上清,不要吸到底部的组织块沉淀,用含20%胎牛血清的DMEM培养基重悬,轻轻吹打混匀,均匀转移至六孔板中,轻轻摇匀,标记时间后放于37℃、体积分数为5%的CO₂饱和湿度培养箱中培养。
- 本次实验采用差速贴壁法去除成纤维细胞,37℃培养1小时,吸取上清液置于另一孔中继续培养,每隔一小时转一次,转移3~4次,4天后换液,以后每天换液1次,直到增殖达到融合。
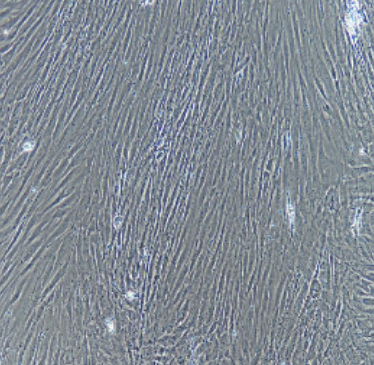
大鼠骨骼肌细胞
04 细胞观察及鉴定
- 差速培养后,细胞24小时后开始贴壁,96小时后完全贴壁,倒置显微镜下每天观察细胞生长及形态特征,传代培养纯化至P3代用于后续试验。
- 采用HE染色和α-actin染色进行骨骼肌细胞鉴定。
- 结果表明:本实验所用的消化液以及差速贴壁法可分离培养出纯度高、活力旺盛的骨骼肌细胞。
05 注意事项
- 消化液的制备及消化时间
合适的消化液以及消化时间的把握,是实验取材的关键。合适的消化液利于骨骼肌细胞从基膜中释放出来。作用时间不足则获得细胞较少,作用时间过长则可致细胞受损、生长状态不良。
- 肌肉组织要尽可能剔除表面的膜和脂肪组织
肌肉组织表面的膜和脂肪组织去除利于后续细胞的纯化,减少传代次数,获得纯度高的骨骼肌细胞。
- 纤维细胞的去除
本实验采用差速贴壁法去除成纤维细胞,37 ℃培养 1 小时后移至另一孔进行培养,转移两次,有效去除骨骼肌细胞中的成纤维细胞。
声明:本文使用图片来源于网络和文献,如有侵权请联系删除。

