CUSTOMER
客户中心
助力生命健康领域从基础研究到产业化的加速转化
From: Nature Metabolism,IF=18.9
Abstract
Despite recent progress in cancer treatment, liver metastases persist as an unmet clinical need. Here, we show that arming liver and tumor-associated macrophages in vivo to co-express tumor antigens (TAs), IFNα, and IL-12 unleashes robust anti-tumor immune responses, leading to the regression of liver metastases. Mechanistically, in vivo armed macrophages expand tumor reactive CD8+T cells, which acquire features of progenitor exhausted T cells and kill cancer cells independently of CD4+T cell help. IFNα and IL-12 produced by armed macrophages reprogram antigen presenting cells and rewire cellular interactions, rescuing tumor reactive T cell functions. In vivo armed macrophages trigger anti-tumor immunity in distinct liver metastasis mouse models of colorectal cancer and melanoma, expressing either surrogate tumor antigens, naturally occurring neoantigens or tumor-associated antigens. Altogether, our findings support the translational potential of in vivo armed liver macrophages to expand and rejuvenate tumor reactive T cells for the treatment of liver metastases.
摘要
尽管在癌症治疗方面取得了进展,但肝脏转移瘤仍然是一个未满足的临床需求。在这里,我们展示了通过在体内激活肝脏和肿瘤相关巨噬细胞来共同表达肿瘤抗原(TAs)、干扰素α(IFNα)和白介素-12(IL-12),可以激发强大的抗肿瘤免疫反应,从而导致肝脏转移瘤的消退。在机制上,体内激活的巨噬细胞扩增了肿瘤反应性的CD8+T细胞,这些细胞获得了祖细胞耗竭T细胞的特征,并且能够独立于CD4+T细胞的帮助杀死癌细胞。激活巨噬细胞产生的IFNα和IL-12重新编程了抗原呈递细胞并重新连接了细胞间的相互作用,从而挽救了肿瘤反应性T细胞的功能。在体内激活的巨噬细胞在不同的肝脏转移小鼠模型中触发了抗肿瘤免疫反应,这些模型包括表达替代肿瘤抗原、自然发生的新生抗原或肿瘤相关抗原的结直肠癌和黑色素瘤。总的来说,我们的发现支持了体内激活肝脏巨噬细胞扩增和复兴肿瘤反应性T细胞以治疗肝脏转移瘤的转化潜力。
内容总结
这篇文章的核心内容是关于一种新的癌症治疗方法,即通过在体内激活肝脏和肿瘤相关巨噬细胞(macrophages)来表达肿瘤抗原(TAs)、干扰素α(IFNα)和白介素-12(IL-12),从而激发强大的抗肿瘤免疫反应,导致肝脏转移瘤的消退。研究团队通过一系列实验,展示了这种治疗方法在小鼠模型中的有效性,并探讨了其潜在的机制和临床转化潜力。
背景知识:
肝脏转移瘤(LM)是癌症治疗中的一个未满足的临床需求。尽管在癌症治疗方面取得了进展,但肝脏转移瘤的治疗仍然是一个挑战。肝脏因其与消化道的密切联系以及在解毒和血液过滤中的作用,具有免疫抑制特性,这有利于肝脏转移瘤的生长,并降低了旨在激活免疫反应的疗法的疗效。
研究方法:
研究者们采用了基于慢病毒载体(LV)的基因治疗策略,通过单次静脉注射,选择性地在肝脏和肿瘤相关巨噬细胞中同时表达TAs、IFNα和IL-12。他们首先在C57BL/6小鼠中进行了实验,使用不同的LV剂量处理小鼠,并在处理后14天通过肝内注射结直肠癌(CRC)样细胞系MC38来模拟肝脏转移瘤。通过流式细胞术(FC)检测OVA特异性CD8+T细胞的扩增情况,并评估了不同处理对肿瘤生长的影响。
实验结果:
中等剂量的IiOVA LV治疗效果最佳: 实验发现,中等剂量(107TU/小鼠)的IiOVA LV处理能够显著减少肿瘤生长,且有5/9的小鼠完全消除了肝脏转移瘤。此外,IiOVA处理的小鼠在血液和肝脏中OVA特异性CD8+T细胞的扩增呈剂量依赖性。
IFNα和IL-12的联合表达增强了T细胞活性: 研究者们进一步研究了IFNα和IL-12的联合表达对T细胞活性的影响。结果显示,与单独表达IiOVA相比,联合表达IFNα和IL-12(OVA.Combo组)的小鼠在肿瘤控制方面表现出了更高的治疗响应,有4/9的小鼠完全消除了肝脏转移瘤,并且在剩余的小鼠中,OVA表达的癌细胞克隆几乎被完全清除。
单细胞RNA测序(scRNA-seq)揭示了免疫细胞的变化: 通过scRNA-seq分析,研究者们发现OVA.Combo处理能够增加抗原呈递细胞(APCs)中MHC-I和MHC-II抗原呈递相关基因的表达,同时减少与免疫抑制和促肿瘤功能相关的基因表达。此外,OVA.Combo处理还增加了CD8+T细胞中PEX表型的表达,减少了TEX表型的表达,表明了T细胞的激活和功能改善。
IFNα和IL-12的联合表达独立于CD4+T细胞帮助: 研究还发现,IFNα和IL-12的联合表达能够激活OVA特异性CD8+T细胞,且这一过程独立于CD4+T细胞的帮助。即使在没有MHC-II限制性肽段的情况下,IFNα和IL-12的联合表达也能够促进CD8+T细胞的激活和肿瘤清除。
自然发生的TAs与IFNα和IL-12联合治疗的效果: 研究者们还测试了自然发生的TAs(如B16-F10黑色素瘤细胞中的TRP-2)与IFNα和IL-12联合治疗的效果。结果显示,与单独使用IFNα和IL-12相比,联合治疗(Trp2.Combo)在抑制黑色素瘤和CRC肝脏转移瘤生长方面更为有效。
关键结论:
通过在肝脏巨噬细胞中同时表达TAs、IFNα和IL-12,可以有效地激活CD8+T细胞,导致肝脏转移瘤的消退。
IFNα和IL-12的联合表达能够增强T细胞的活性和功能,这一过程独立于CD4+T细胞的帮助。
该治疗方法在不同的小鼠模型中均显示出良好的疗效,包括对免疫检查点抑制剂无反应的肿瘤模型。
该研究提供了一种新的癌症治疗策略,即通过基因治疗手段在肝脏巨噬细胞中表达TAs和免疫激活细胞因子,以激发抗肿瘤免疫反应。
图文摘要
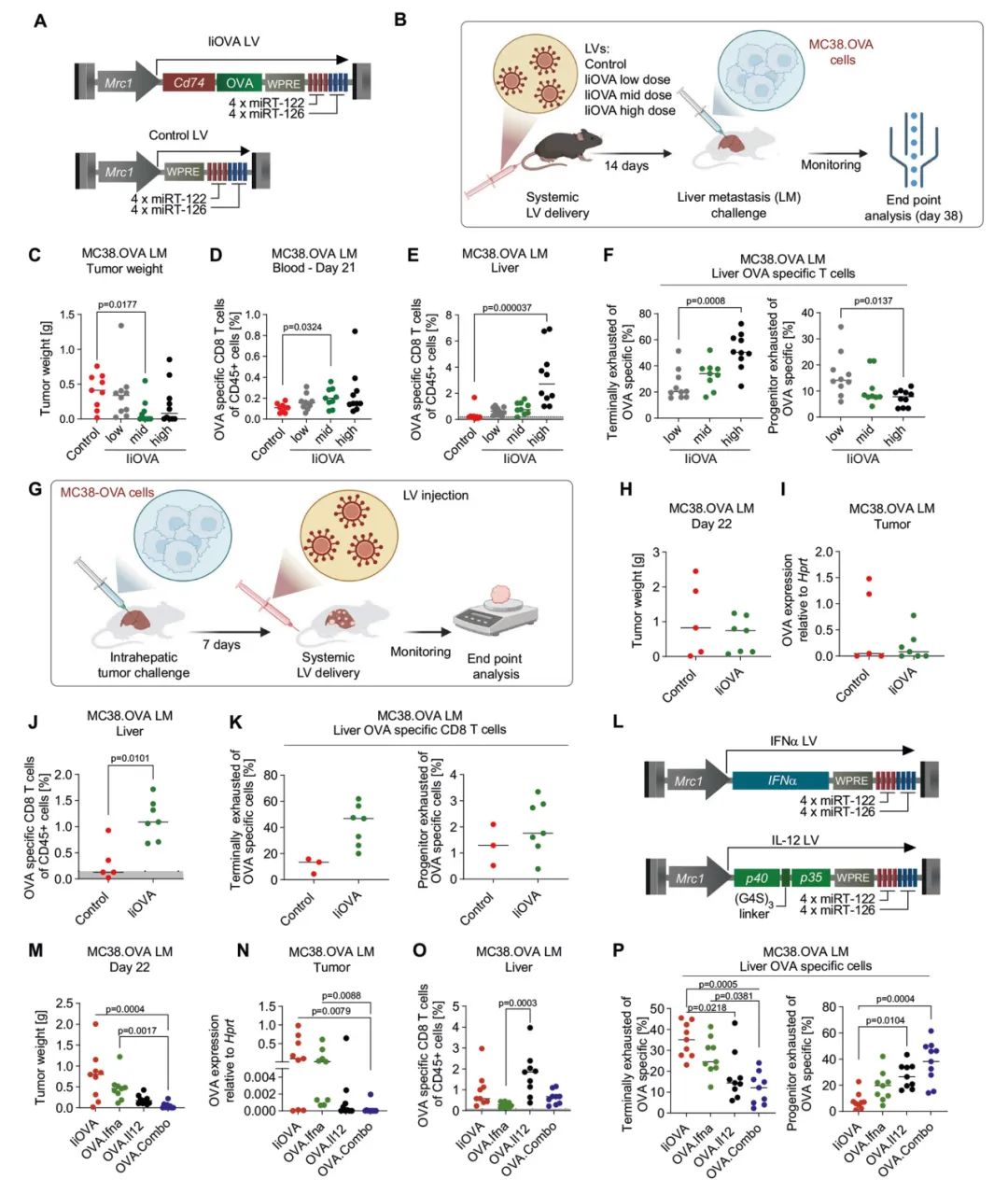
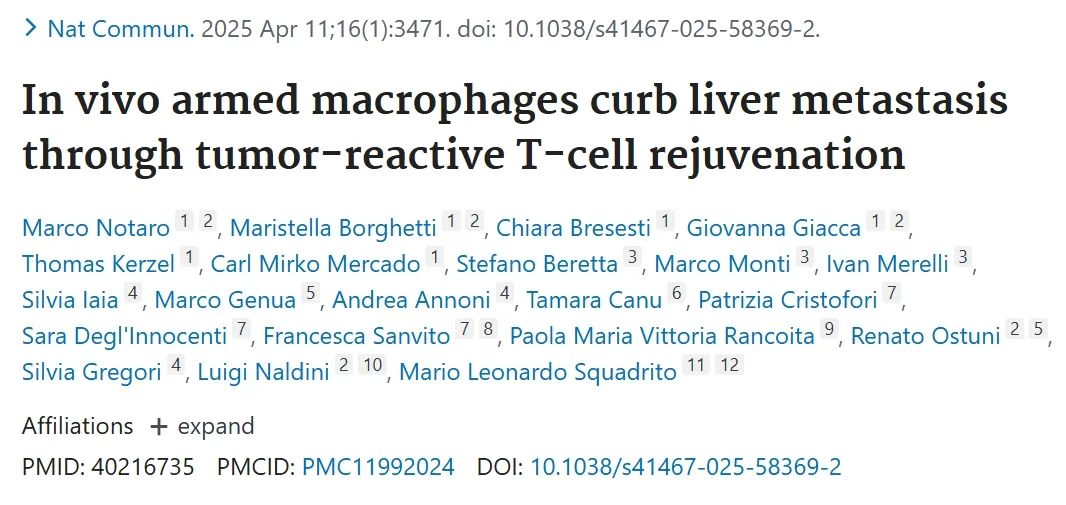
图1:协调表达IFNα和IL-12恢复肿瘤反应性T细胞活性
A:LVs(慢病毒载体)的设计示意图。
B:实验流程示意图(C–F)。从C57BL/6小鼠的尾静脉注射不同剂量的IiOVA LV(低剂量:10⁶ TU/小鼠,中剂量:10⁷ TU/小鼠,高剂量:10⁸ TU/小鼠)或对照LV(10⁸ TU/小鼠),14天后进行肝内肿瘤细胞植入。
C:肝转移瘤重量(每组小鼠数量分别为9、10、9、10,水平线表示中位数,统计分析采用Kruskal–Wallis检验,随后进行Dunn检验,*p ≤ 0.05)。
D:通过流式细胞术(FC)检测OVA特异性CD8⁺ T细胞的百分比(小鼠数量和统计方法同C)。
E:肝脏的FC分析结果(小鼠数量和统计方法同C)。
F:肝脏的FC分析结果(小鼠数量分别为10、9、10,水平线表示中位数,统计分析采用Kruskal–Wallis检验,随后进行Dunn检验,*p ≤ 0.05)。
G:实验流程示意图(H–K和M–P)。
H:肿瘤重量(每组小鼠数量分别为5、7,水平线表示中位数,统计分析采用Mann–Whitney检验,*p ≤ 0.05)。
I:对残留肝转移瘤进行OVA基因表达分析(小鼠数量和统计方法同H)。
J、K:肝脏的FC分析结果(小鼠数量分别为3、7,水平线表示中位数,统计分析采用Mann–Whitney检验,*p ≤ 0.05)。
L:LVs的设计示意图,用于递送细胞因子。
M:在MC38.OVA肿瘤植入后7天,对小鼠进行IiOVA、OVA.Ifna(IFNα)、OVA.Il12(IL-12)或OVA.Combo(IFNα+IL-12)治疗(IiOVA剂量为1×10⁷ TU/小鼠,OVA.Ifna总剂量为1.1×10⁸ TU/小鼠,OVA.Il12总剂量为1.1×10⁷ TU/小鼠,OVA.Combo总剂量为1.2×10⁸ TU/小鼠)。肿瘤重量(每组9只小鼠,水平线表示中位数,统计分析采用Kruskal–Wallis检验,随后进行Dunn检验,*p ≤ 0.05)。
N:对残留肝转移瘤进行OVA基因表达分析(小鼠数量和统计方法同M)。
O、P:肝脏的FC分析结果(小鼠数量和统计方法同M)。
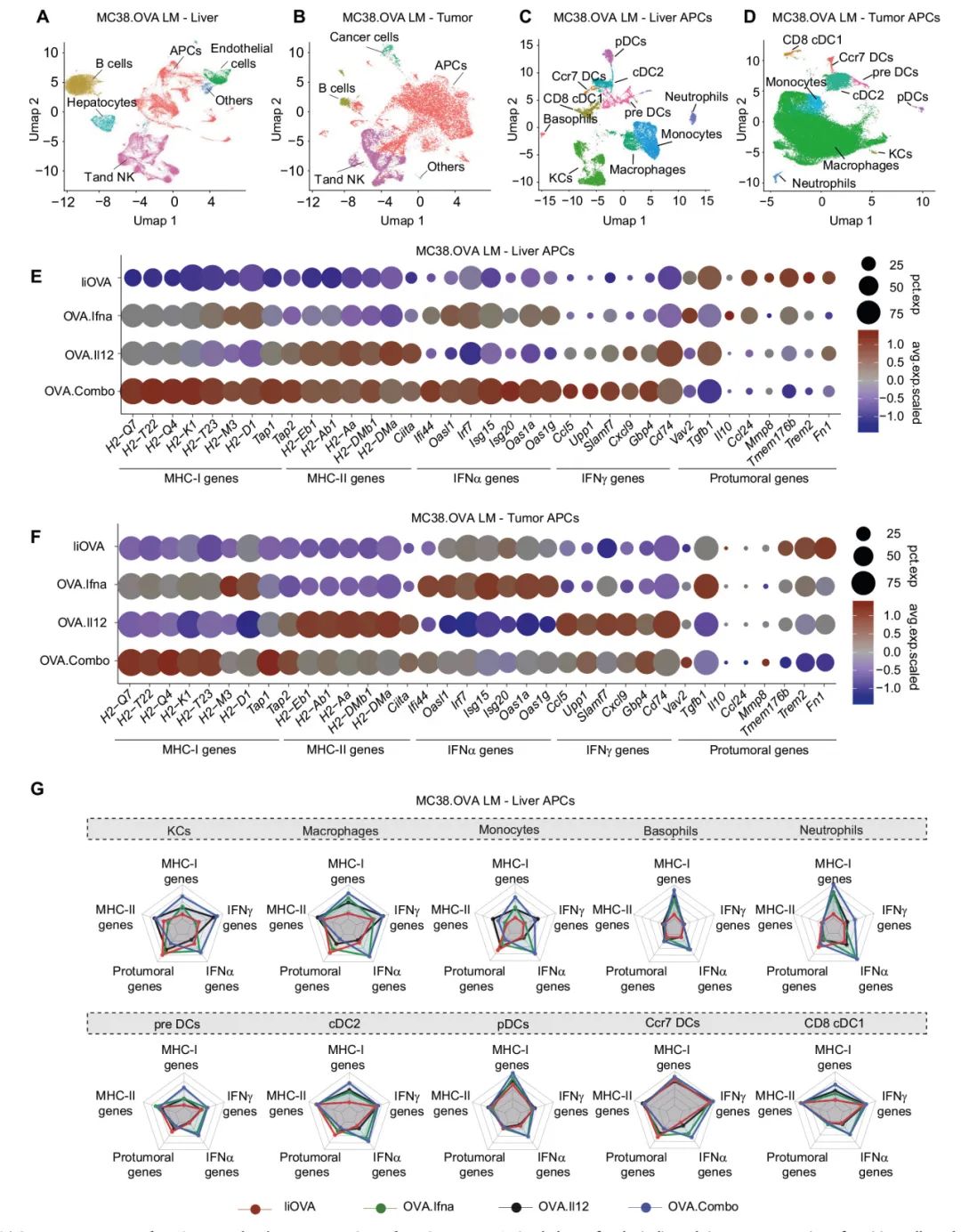
图2:同时表达IFNα和IL-12增加MHC-I和MHC-II在肝转移瘤中的呈递
A、B:UMAP投影图,显示从健康肝脏(A)或匹配的肝转移瘤(B)中分离的CD45⁺细胞的单细胞RNA测序(scRNA-seq)数据。
C、D:APC亚群的UMAP投影图,显示不同组织中的细胞类型。
E、F:在不同组织的APCs中,与指示生物学过程相关的选定基因的阳性细胞比例和平均表达水平的缩放值(每组小鼠数量分别为2、3、3、3)。
G:在不同肝脏髓系细胞群中,与指示类别相关的基因的综合表达评分。
图3:同时表达IFNα和IL-12改善CD4⁺T和肿瘤抗原特异性CD8⁺ T细胞的适应性
A:UMAP投影图,显示肝脏T和NK细胞亚群的scRNA-seq数据。
B:GSEA分析显示,与IiOVA组相比,T和NK细胞中差异表达基因的标准化富集分数(NES)。
C:在肝脏CD8⁺T细胞中,与指示类别相关的基因的综合表达评分。
D:在肝脏CD8⁺T细胞中,与指示生物学过程相关的选定基因的阳性细胞比例和平均表达水平的缩放值(小鼠数量同B)。
E:UMAP投影图,显示携带OVA特异性TCR的细胞。
F:GSEA分析显示,与IiOVA组相比,OVA特异性CD8⁺ T细胞中差异表达基因的NES。
G:在OVA特异性CD8⁺T细胞中,与指示类别相关的基因的综合表达评分。
H:在肝脏中,CD4⁺T细胞克隆型在肝脏和肿瘤组织之间的共享情况。
I:UMAP投影图,显示CD4⁺T细胞克隆型在肝脏和肿瘤组织之间的共享情况。
J:肝脏中CD4⁺T细胞群的百分比(每组小鼠数量分别为2、3、3、3,水平线表示均值,误差条表示标准误)。
K:按TCR克隆型频率划分的CD4⁺T细胞数量。
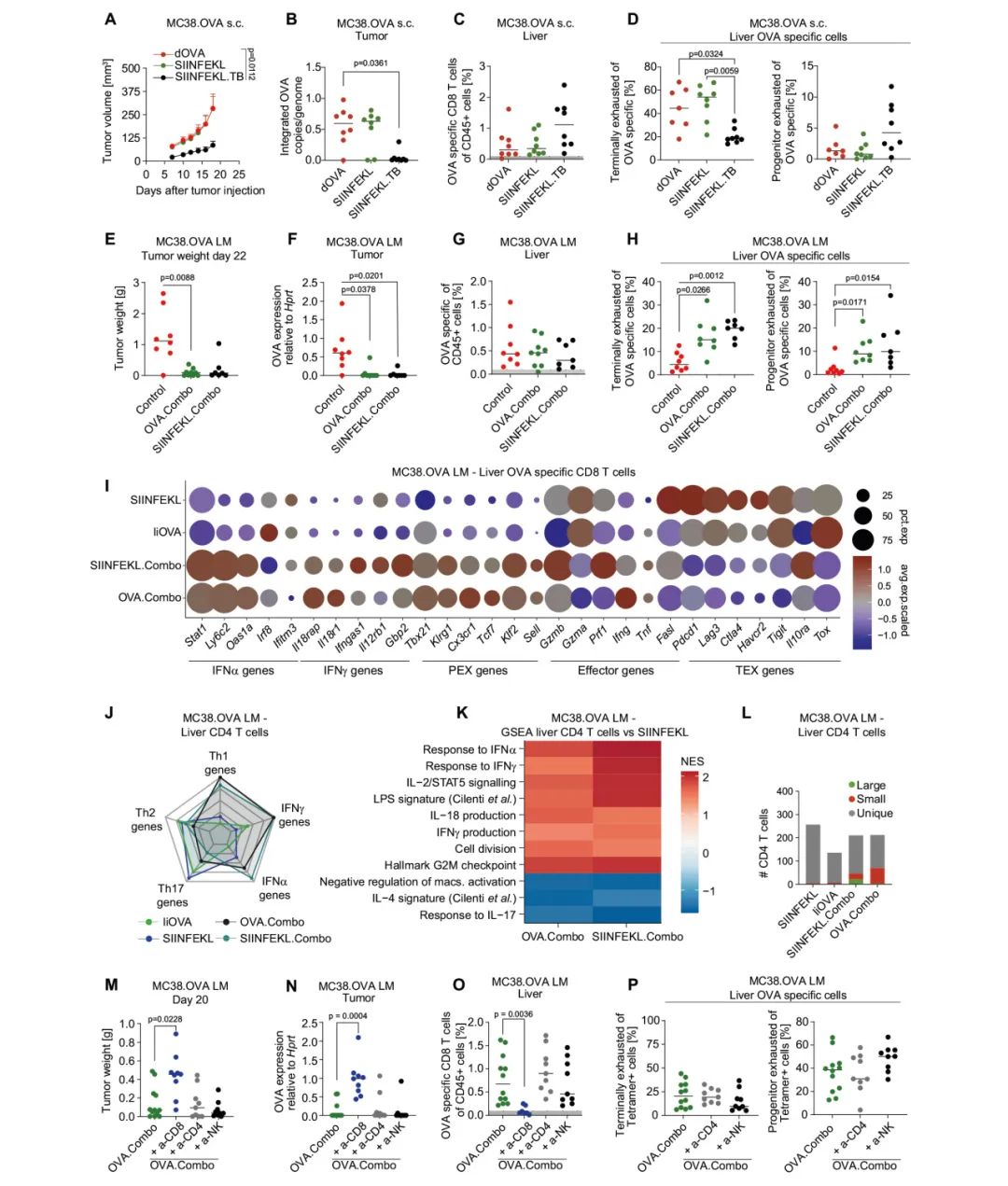
图4:协调递送IFNα和IL-12激活肿瘤抗原特异性CD8⁺T细胞,独立于CD4⁺T细胞辅助
A–D:通过尾静脉注射dOVA、SIINFEKL或SIINFEKL.TB LV(10⁷ TU/小鼠)处理小鼠,14天后皮下植入MC38.OVA细胞。A:皮下肿瘤生长曲线(每组8只小鼠,均值±标准误;统计分析采用双侧Mann–Whitney检验,对曲线下面积进行分析,*p ≤ 0.05)。B:通过ddPCR分析肿瘤中LV拷贝数/基因组(小鼠数量同A;水平线表示中位数;统计分析采用Kruskal–Wallis检验,随后进行Dunn检验,*p ≤ 0.05)。C、D:肝脏的FC分析结果(小鼠数量和统计方法同B,低于深灰色区域的值不纳入进一步分析)。
E–H:在肿瘤植入后7天,对小鼠进行OVA.Combo或SIINFEKL.Combo治疗(总剂量1.2×10⁸ TU/小鼠;对照组小鼠未处理)。E:肿瘤重量(每组小鼠数量分别为8、9、7,水平线表示中位数,统计分析采用Kruskal–Wallis检验,随后进行Dunn检验,*p ≤ 0.05)。F:对残留肝转移瘤进行OVA基因表达分析(小鼠数量和统计方法同E)。G、H:肝脏的FC分析结果(小鼠数量和统计方法同E)。
I:在肝脏OVA特异性CD8⁺T细胞中,选定基因的表达情况(每组1只小鼠)。
J:在肝脏CD4⁺T细胞中,与指示类别相关的基因的综合表达评分(每组1只小鼠)。
K:GSEA分析显示,与IiOVA组相比,肝脏CD4⁺T细胞中差异表达基因的NES(每组1只小鼠)。
L:按TCR克隆型频率划分的CD4⁺T细胞数量(每组1只小鼠)。
M–P:小鼠通过尾静脉注射MC38.OVA细胞,6天后腹腔注射抗CD4、抗CD8或抗NK1.1单克隆抗体。7天后,小鼠注射OVA.Combo(总剂量1.2×10⁸ TU/小鼠),随后每周两次腹腔注射相应单抗。M:肿瘤重量(每组小鼠数量分别为12、9、9、9,水平线表示中位数,统计分析采用Kruskal–Wallis检验,随后进行Dunn检验,比较所有组与OVA.Combo组,*p ≤ 0.05)。N:对残留肝转移瘤进行OVA基因表达分析(小鼠数量和统计方法同M)。O、P:肝脏的FC分析结果(小鼠数量和统计方法同M)。
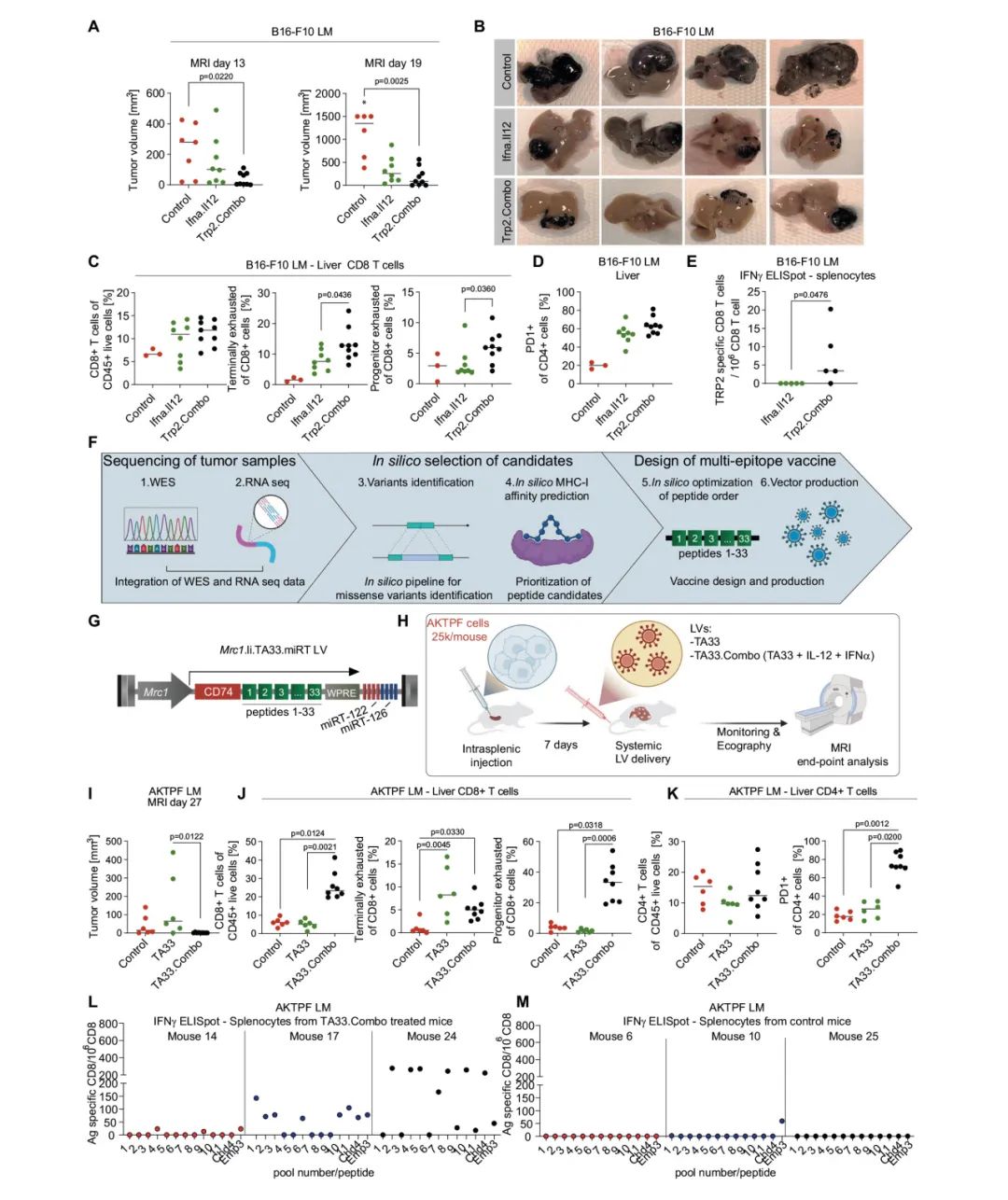
图5:同时递送天然肿瘤抗原与IFNα和IL-12通过扩展和重编程肿瘤抗原反应性CD8⁺T细胞抑制黑色素瘤和CRC肝转移瘤生长
A–E:在B16-F10肝转移瘤小鼠模型中,对小鼠进行Ifna.Il12或Trp2.Combo治疗(Ifna.Il12总剂量1.1×10⁸ TU/小鼠,Trp2.Combo总剂量1.2×10⁸ TU/小鼠)。A:通过磁共振成像(MRI)在指定时间点量化肝转移瘤体积(每组小鼠数量分别为7、8、9,水平线表示中位数,统计分析采用Kruskal–Wallis检验,随后进行Dunn检验,*p ≤ 0.05,*表示1只对照组小鼠在进行MRI分析前死亡)。B:对照组未处理、Ifna.Il12或Trp2.Combo处理小鼠肝脏的代表性图像。C、D:肝脏的FC分析结果(每组小鼠数量分别为3、8、9,水平线表示中位数,统计分析采用Mann–Whitney检验,比较Ifna.Il12和Trp2.Combo组,*p ≤ 0.05)。E:对小鼠脾脏中分离的CD8⁺T细胞进行IFNγ ELISPOT分析(每组5只小鼠,水平线表示中位数,统计分析采用双侧Mann–Whitney检验,*p ≤ 0.05)。
F:用于识别AKTPF肝转移瘤模型中新生抗原的抗原预测流程图。
G:TA33 LV的设计示意图。
H:实验流程示意图(I–M)。
I–M:对小鼠进行TA33或TA33.Combo治疗(TA33剂量为1×10⁷ TU/小鼠,TA33.Combo总剂量为1.2×10⁸ TU/小鼠)。I:通过MRI在肿瘤注射后第27天量化肝转移瘤体积(每组小鼠数量分别为6、6、9,水平线表示中位数,统计分析采用Kruskal–Wallis检验,随后进行Dunn检验,*p ≤ 0.05)。J、K:肝脏的FC分析结果(每组小鼠数量分别为6、6、8,统计方法同I)。L、M:对小鼠脾脏中分离的CD8⁺ T细胞进行IFNγ ELISPOT分析(每组3只小鼠)。
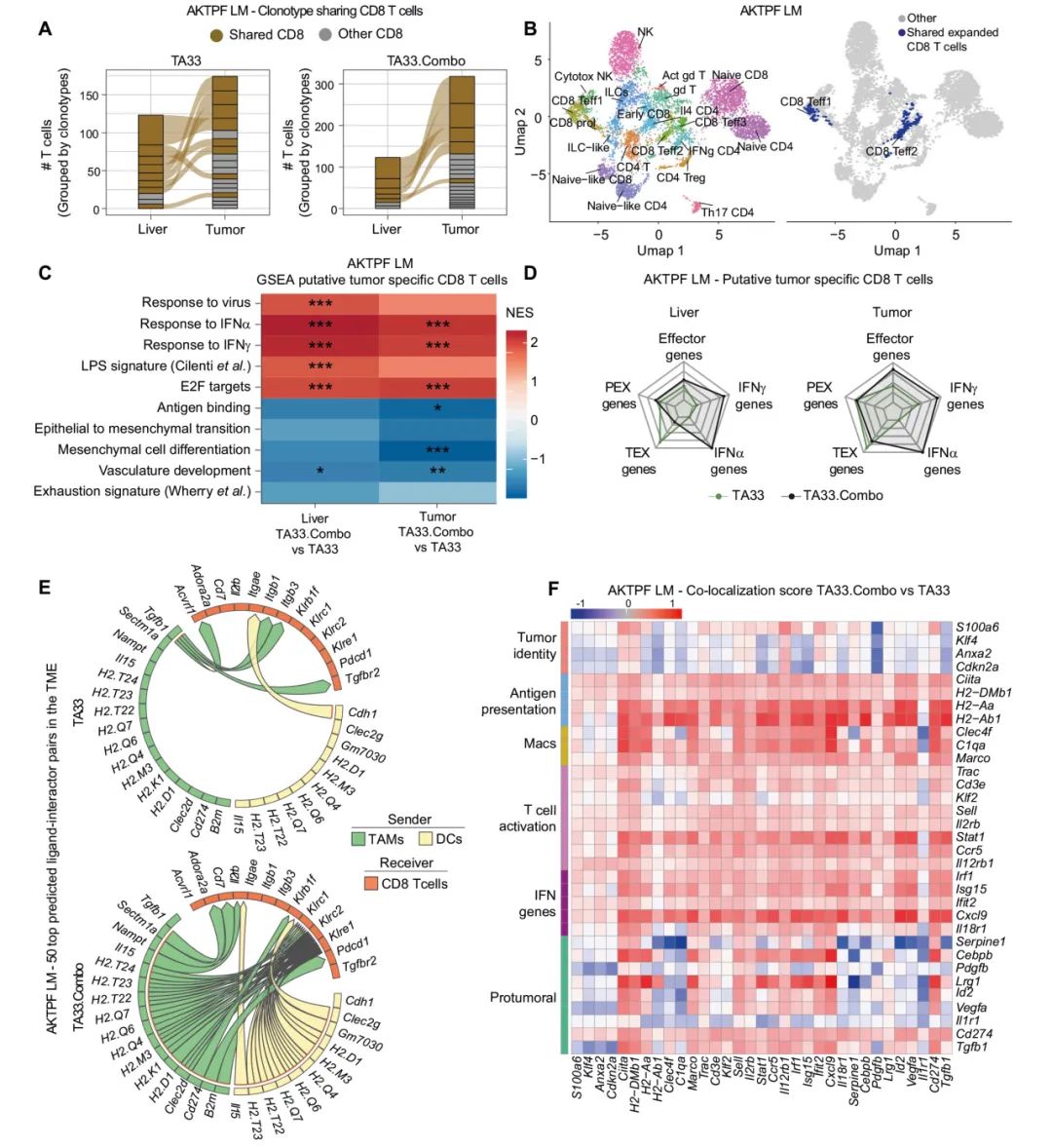
图6:IFNα和IL-12在转移瘤微环境中重编程免疫回路,激活肿瘤抗原特异性T细胞活性
A:在肝脏CD8⁺T细胞中,按TCR克隆型分组的克隆型共享情况(每组3只小鼠)。
B:UMAP投影图,显示肝脏T和NK细胞亚群的scRNA-seq数据,右侧为共享和扩展的CD8⁺T细胞的表示。
C:GSEA分析显示,与TA33组相比,假定的肿瘤反应性CD8⁺ T细胞中差异表达基因的NES(每组3只小鼠;统计分析采用自适应多水平分裂蒙特卡洛方案;:padj < 0.05;:padj < 0.005;:padj < 0.0005)。
D:在指示组织中,假定的肿瘤反应性CD8⁺T细胞中与指示类别相关的基因的综合表达评分。
E:通过MultiNicheNet分析,显示肿瘤scRNA-seq中前50个差异配体-受体对的Circos图。上方为TA33组,下方为TA33.Combo组。箭头表示从发送者到接收者的方向,箭头的颜色表示表达配体的发送者细胞类型。
F:通过MERSCOPE在肝脏组织切片上检测的转录本的共定位评分的热图,比较TA33.Combo与TA33处理的小鼠。样本包括健康肝脏实质和肝转移瘤。共定位评分是通过比较TA33.Combo与TA33处理的小鼠的转录本计算得出的。
图7:TA、IFNα和IL-12 LVs通过扩展肿瘤抗原特异性PEX CD8⁺ T细胞恢复对免疫治疗的反应
A:转移瘤患者的Kaplan–Meier生存曲线,根据TCGA数据库中的IIT评分高低进行分组(n = 427,统计分析采用Cox回归的Wald检验)。
B:IIT评分对风险比(HR)的影响。误差条表示回归系数的标准误。PCPG(n = 203,p = 0.020),SKCM(n = 483,p = 0.000011),SARC(n = 281,p = 0.037),LIHC(n = 532,p = 0.022),HNSC(n = 684,p = 0.019),LUAD(n = 756,p = 0.038),OV(n = 441,p = 0.097),KIRC(n = 1080,p = 0.030),ESCA(n = 228,p = 0.071),LGG(n = 548,p = 0.000171)。
C:接受a-PD1治疗的转移瘤患者的Kaplan–Meier生存曲线,根据IIT评分高低进行分组(n = 121)。统计分析方法同A。
D:实验流程示意图(E–G和H–L)。
E–G:对小鼠进行B16-F10肝转移瘤治疗(对照组未处理,Trp2.Combo总剂量1.2×10⁸ TU/小鼠)。 E:通过MRI测量肝转移瘤体积(每组小鼠数量分别为5、8、6、7,水平线表示中位数,统计分析采用Kruskal–Wallis检验,随后进行Dunn检验,*p ≤ 0.05)。*表示1只小鼠在进行MRI分析前死亡。F:代表性MRI图像。G:肝脏的FC分析结果(每组小鼠数量分别为3、5、6、7,水平线表示中位数,统计分析采用Kruskal–Wallis检验,随后进行Dunn检验,*p ≤ 0.05)。
H–L:对小鼠进行MC38.OVA肝转移瘤治疗(对照组LV剂量为1.2×10⁸ TU/小鼠,OVA.Combo总剂量为1.2×10⁸ TU/小鼠)。H:血液的FC分析结果(每组小鼠数量分别为9、7、8、9,水平线表示中位数,统计分析采用Kruskal–Wallis检验,随后进行Dunn检验,*p ≤ 0.05)。I:肿瘤重量(小鼠数量和统计方法同H)。J:对残留肝转移瘤进行OVA基因表达分析(小鼠数量和统计方法同H)。K:肝脏的FC分析结果(小鼠数量和统计方法同H)。L:肝脏的FC分析结果(小鼠数量和统计方法同H)。
参考文献:
Notaro M, Borghetti M, Bresesti C, Giacca G, Kerzel T, Mercado CM, Beretta S, Monti M, Merelli I, Iaia S, Genua M, Annoni A, Canu T, Cristofori P, Degl'Innocenti S, Sanvito F, Rancoita PMV, Ostuni R, Gregori S, Naldini L, Squadrito ML. In vivo armed macrophages curb liver metastasis through tumor-reactive T-cell rejuvenation. Nat Commun. 2025 Apr 11;16(1):3471. doi: 10.1038/s41467-025-58369-2. PMID: 40216735; PMCID: PMC11992024.