CUSTOMER
客户中心
助力生命健康领域从基础研究到产业化的加速转化
细胞表面分子的检测与分析
在流式细胞术中,细胞表面分子的检测与分析占重要地位。细胞在分化的不同阶段以及活化过程中,其细胞膜表面可表达供鉴别的特殊结构,即表面分子,也称表面标志。
利用荧光素标记单克隆抗体,可对这些细胞表面标志进行流式细胞术检测,进而分析细胞的种类、亚类以及功能特性。流式细胞术在细胞表面分子的检测与分析中主要应用于:
①免疫细胞及其亚群的检测与功能分析:包括检测T淋巴细胞、B淋巴细胞、NK细胞以及DC细胞等比例,检测免疫细胞的活性细胞水平等;
② 血液系统疾病细胞表面标志的研究与临床应用:目前已将淋巴细胞亚群的分类方法引申到血液系统疾病的研究、分类和诊断上。用该技术对白血病细胞进行免疫分型,可以更多地了解这些疾病的生物学特征,提供更合理的免疫诊断方法(详见第三篇)。以八色流式细胞术检测外周血单个核细胞中的各淋巴细胞及其亚群为例,介绍流式细胞术在细胞表面分子的检测与分析中的应用。
1. 抗体选择
CD3-FITC,CD127-PE,CD4-PerCP-Cy5.5,CD56-PE-Cy7,CD2-APC,CD4APC-Cy7,CD16-BV421,CD8-BV510。
2. 样本选择
空白对照、荧光补偿对照与FMO对照。
3. 操作方法
流式样本染色方法。
4. 流式结果分析
根据实验目的绘制散点图,设门,显示并解读数据(图1)。

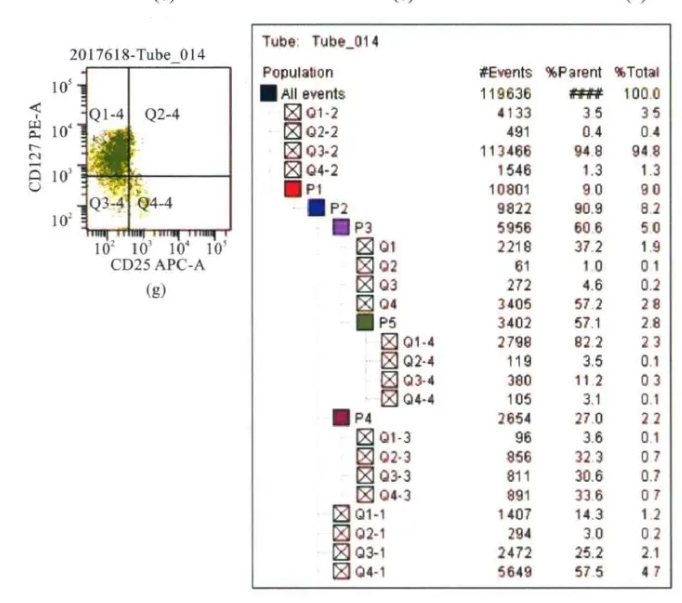
图1 八色流式细胞术分析外周血单个核细胞各淋巴细胞及其亚群的表型
注:T淋巴细胞占单个核细胞的比例为60.6%(P3,f),辅助/诱导性T淋巴细胞(CD3+CD4+细胞)占CD3+细胞的比例为57.2%(Q4或P5,d);抑制/细胞毒性T淋巴细胞(CD3+CD8+细胞)占CD3+细胞的比例为37.2%(Q1,d);NKT淋巴细胞(CD3+CD56+细胞)占单个核细胞的比例为3.0%(Q2-1,c);NK细胞(CD3-CD56+CD16-细胞)占CD3-单个核细胞的比例为32.3%(Q2-3,e),通过计算可得出NK细胞占单个核细胞的比例为32.3%×27.0%=8.72%;Treg细胞(CD4+CD25+CD127low细胞)占CD4+T淋巴细胞的比例为3.1%(Q4-4,g)。
细胞内或细胞核内抗原检测与分析
流式细胞术分析细胞内或细胞核内抗原的关键在于要使荧光标记的单克隆抗体能自由进入细胞内或细胞核内,且不能破坏细胞形态的完整性和保持细胞内靶抗原结构不变。因上述要求,与细胞表面抗原的检测和分析相比,流式细胞术分析细胞内或细胞核内抗原的主要区别在于细胞固定(保持细胞形态的完整性)和使胞膜或核膜穿透(使荧光标记的单克隆抗体能自由进入)。
1. 基本步骤
刺激或收获细胞→阻断细胞膜表面Fc受体→细胞膜表面抗原染色→细胞固定→细胞透膜→胞内或核内抗原染色→流式细胞分析。
2. 主要试剂
(1)4%多聚甲醛PBS(临用前配制):在磁力搅拌下,将4g多聚甲醛(EM级)溶于100mL PBS,加入数滴NaOH溶液,在通风柜中于60°C加热(打开瓶盖)使其溶解,冷却至室温,调整pH值为7.4。
(2) Fix&-Perm(包括固定/穿膜剂以及洗液Pern/wash.BD公司)。
(3)含0.1%皂苷的PBS或含0.1%皂苷的HEPES溶液(0.1%皂苷,1mmol/L CaCl2,1 mmol/L MgSO 4,0.5% NaN3,1% BSA10 mmol/L HEPES)。
3. 基本操作
室温固定10min,室温穿膜5~10min。
4. 结果
商品化试剂最好,细胞形态完整,细胞碎片少。含0.1%皂苷的PBS与商品化试剂作用较接近,而含0.1%皂苷的HEPES溶液背景较高,对阳性率影响较大。
(1)细胞固定剂和穿膜剂的选择 理想的固定方法应该是使抗原固定的同时保持细胞、亚细胞结构的真实性,使抗体能够充分地与所有细胞、亚细胞结构内的成分接触。
固定方法可分为两大类,它们或使细胞蛋白成分沉淀于局部其他亚细胞结构上(沉淀法),或通过化学键与细胞内其他分子连接(交联法)。两类方法均能使抗原物质维持于原位,但也均会导致抗原性发生改变。常用的固定剂种类很多,固定剂的正确选择取决于被研究抗原的性质及所用抗体的特性。
固定剂可分为两大类:有机溶剂和交联剂。有机溶剂(如甲醇、乙醇和丙酮)能够迅速溶解脂类物质,使细胞脱水,将蛋白质沉淀在细胞结构上,但其会导致许多被抗体识别的表位发生改变(即抗原表位改变或丢失)。由于这类固定剂的溶脂作用,即对细胞已经产生了通透作用,故在随后的步骤中不必用穿膜剂进行穿膜。交联剂(如多聚甲醛溶液)一般是通过自由氨基基团把生物分子桥连起来,形成一个相互连接的抗原网,但这种方法也会使那些识别某些氨基酸残基的抗体不能与这些基团结合。由于多聚甲醛溶液没有穿膜作用,故在随后的步骤中需经去污剂溶解脂类成分进行穿膜,从而增强细胞的通透性。
两类固定方法相比,使用交联剂固定细胞可以获得较好的结果,但没有通用规则可以参考,可以先试用这两种方法,然后选择较好的一种。一般主张使用商品化的固定剂和穿膜剂,如Fix&Perm(美国Caltag公司)、FACS Permeabilizing Solution(BD公司)、Cyto-fix/Cytoperm(Pharmingen)、PermeaFix(Ortho Diagnostic Systems)等。Groenevld等曾对四种固定/穿膜剂(分别来自四个知名的流式试剂生产商)进行了详细的分析,结果表明即使是商品化的试剂,其对细胞内抗原的改变程度差异也较大(表1)。
注:TdT、cyCD3、cylg和MPO都为胞内抗原,cy代表细胞内,+代表可靠地检测出来,-代表检测结果不准确。
穿膜剂一般为去污剂,如Triton X-100、NP-40或皂苷(saponin)。Triton X-100、NP-40穿膜作用较强,而皂苷较温和。穿膜剂的好坏取决于其能否保持细胞形态的完整性和是否影响染色背景。
在实际工作中也可以使用多聚甲醛溶液作为固定剂,以Triton X-100、NP-40或皂苷作为穿膜剂进行透膜处理。不同细胞穿膜剂的使用浓度或作用时间不同,均需预先摸索最佳条件。建议以0.1%皂苷、含0.2%TritonX-100或NP-40的PBS为基础,摸索出适合自己标本的应用浓度与作用时间。张贇等报道的三种固定/穿膜剂对细胞内细胞因子检测的影响值得我们借鉴(图2)。
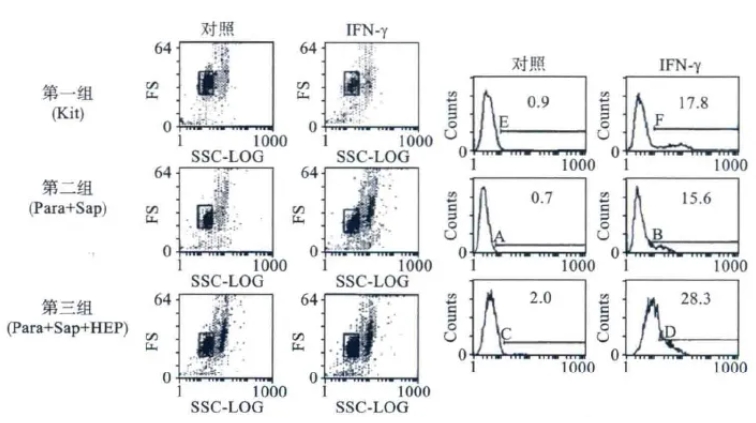
图2 三种固定/打孔液对细胞内细胞因子染色的影响
(2)最佳抗体浓度的选择 在胞内染色及检测过程中荧光抗体的染色浓度对分析和结果至关重要。即使是根据商品化胞内染色抗体推荐的最佳染色浓度进行实验,也应考虑在不同的实验体系中可能产生不同的染色结果(图3)。

图3 不同浓度商品化抗体胞内染色的阳性率
(3)细胞膜内、外 Fc 受体的封闭 在细胞膜表面染色过程中,封闭 Fc 受体是不可或缺的步骤。在进行胞内染色时同样有必要将胞内 Fc 受体封闭,以减少非特异性荧光染色(图4)。选用 Fc 受体阻断试剂时对小鼠可以用纯化的抗小鼠的 CD16/32,对大鼠可以用纯化的抗大鼠的 CD32,对人则可以用过量的同种无关纯化 Ig 或血清。

图4 胞内 Fc 受体封闭对 IFN-γ 染色的影响——未封闭 Fc 受体组有明显的拖尾现象