CUSTOMER
客户中心
助力生命健康领域从基础研究到产业化的加速转化
在动物实验中,出于取材、减少动物痛苦等需要,我们要对动物进行处死。实验动物的处死方法很多,可根据动物实验目的、实验动物品种(品系)、以及需要采集标本的部位等因素,选择不同的处死方法。无论采用哪一种方法,都应遵循安乐死的原则。安乐死是指在不影响动物实验结果的前提下,使实验动物短时间无痛苦地死亡。处死实验动物时应注意,首先要保证实验人员的安全;其次要确认实验动物已经死亡,通过对呼吸、心跳、瞳孔、神经反射等指征的观察,对死亡作出综合判断;再者要注意环保,避免污染环境,还要妥善处理好尸体。
01 颈椎脱位法
颈椎脱位法常用于大鼠、小鼠。操作者右手抓住小鼠的尾巴,将小鼠放在实验台上,左手按住小鼠头颈部,右手用力向后上方45度拉尾,感觉动物脊柱断开,动物立即死亡。对于体重大于125g的大鼠,应结合麻醉使用。

小鼠脱颈处死
02 空气栓塞法
该方法须结合动物麻醉来使用。常用于兔、犬、猫、豚鼠。此法是向动物静脉注入一定量的空气,使之发生栓塞而死。一般兔、猫的注入空气量为20~40ml,犬大约80~150ml。
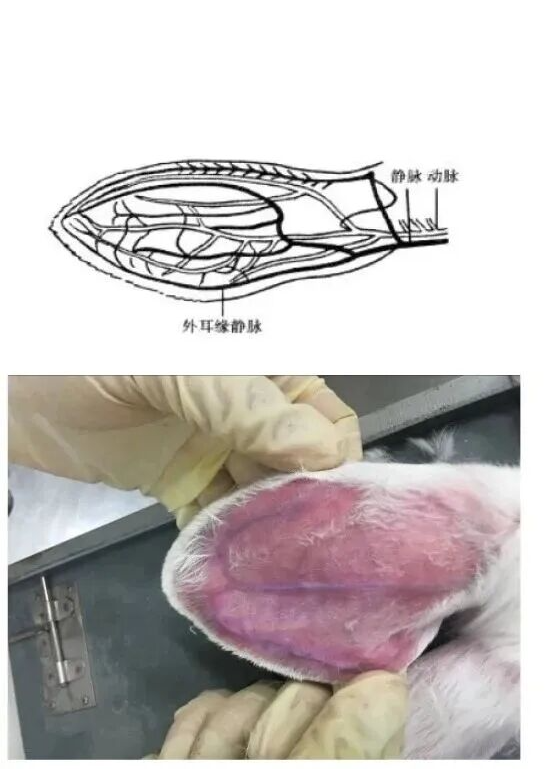
由兔外耳缘静脉注入空气
03 过量麻醉处死
过量巴比妥钠(100mg/kg)处死,静脉或腹腔注射处死。

腹腔注射
04 二氧化碳吸入法
放入动物前,先将二氧化碳灌入密闭的透明塑料箱中20~30s。关闭二氧化碳,放入动物。再将二氧化碳气体通入箱中,封住塑料箱口,1~5min(兔子需要较长时间),确定动物不动、不呼吸、瞳孔放大。停止通入二氧化碳。观察2min,以确定动物死亡。

不同日龄动物CO2暴露时间
05 放血处死法
此法适用于各种实验动物。具体做法是将麻醉后的实验动物股动脉、颈动脉、腹主动脉剪断或剪破、刺穿实验动物的心脏放血,导致急性大出血、休克、死亡。
06 断头处死法
此法适用于鼠类等较小的实验动物。动物断头前,实验人员应对其进行麻醉。操作时,用左手按住实验动物的背部,拇指夹住实验动物右腋窝,食指和中指夹住左前肢,右手用剪刀在鼠颈部垂直将鼠头剪断.使实验动物因脑脊髓断离,且大量出血死亡。使用专用断头器,可以缩短动物的死亡时间,减少其痛苦。
有关实验动物伦理学的研究日益受到重视,对实验动物实施安乐死的方法正在进一步探讨中。
声明:本文使用图片大部分来源于网络和文献,如有侵权请联系删除。