CUSTOMER
客户中心
助力生命健康领域从基础研究到产业化的加速转化
研究背景
经皮递送对患者更友好,理论上有望提升长期依从性并减少注射相关不适,但对蛋白/多肽这类生物大分子而言,皮肤屏障几乎等同于物理隔离层。最关键的瓶颈来自角质层:它由高度有序的脂质结构与脱水角质细胞共同构成,整体偏疏水且致密,能有效阻止大分子扩散。即便部分分子进入表皮,在更深层仍可能受细胞摄取与胞内降解限制,难以形成稳定的系统暴露。因此胰岛素长期依赖皮下注射,带来疼痛、针刺恐惧以及局部皮肤反应等问题,也推动了对非侵入给药路径的持续探索。
01
利用皮肤pH梯度实现可逆电荷转变
该研究提出的关键设计是构建一种具有pH依赖电荷转变能力的聚合物OP。其特征在于:pH≤5时聚合物被质子化呈正电,在接近生理pH时转为中性聚两性离子状态。皮肤天然存在由表层偏酸到深层更接近中性的pH梯度,研究者把材料响应与这一梯度对齐,从而在表层实现更强的吸附与富集,进入更深处后电荷被关闭,分子间与界面间的静电束缚降低,扩散能力增强。作者进一步给出机制框架:聚合物在角质层以下以中性聚两性离子形式存在,主要沿细胞膜进行迁移并逐步进入真皮淋巴系统,最终进入体循环。
02
材料合成与可追踪化
在方法学上,作者首先通过可控聚合调控OP的分子量至约4.5kDa量级,并在链端引入胺基作为通用反应位点,便于后续荧光标记与偶联。合成路线遵循保护-聚合-转化-脱保护的聚合物化学逻辑:先制备带Boc保护的链转移剂,聚合得到保护态前体聚合物,再通过氧化将其转化为目标结构,最后脱保护获得带胺基的OP-NH2。为了实现体内追踪,作者将Cy5与端基偶联得到OPCy5,从而在尽量不扰动主体结构的前提下获得可视化工具分子。03
穿透性验证
作者搭建了由宏观到微观的证据链。其一,在小鼠背部皮肤外用OPCy5后,取皮肤并分层切片,可在更深层观察到荧光信号,而对照聚合物PEGCy5主要停留在表面,提示OP具有更强的跨层迁移能力。其二,为回答穿越角质层时具体在哪里通过,研究者将5nm金纳米颗粒连接到OP链上形成OP–AuNPs,对角质层冷冻切片进行HAADF-STEM成像与EDS元素分析,观察到颗粒主要位于角质层细胞间脂质层中。该结果把进入角质层从定性描述推进到路径定位层面,直指大分子经皮递送最难跨越的核心屏障。
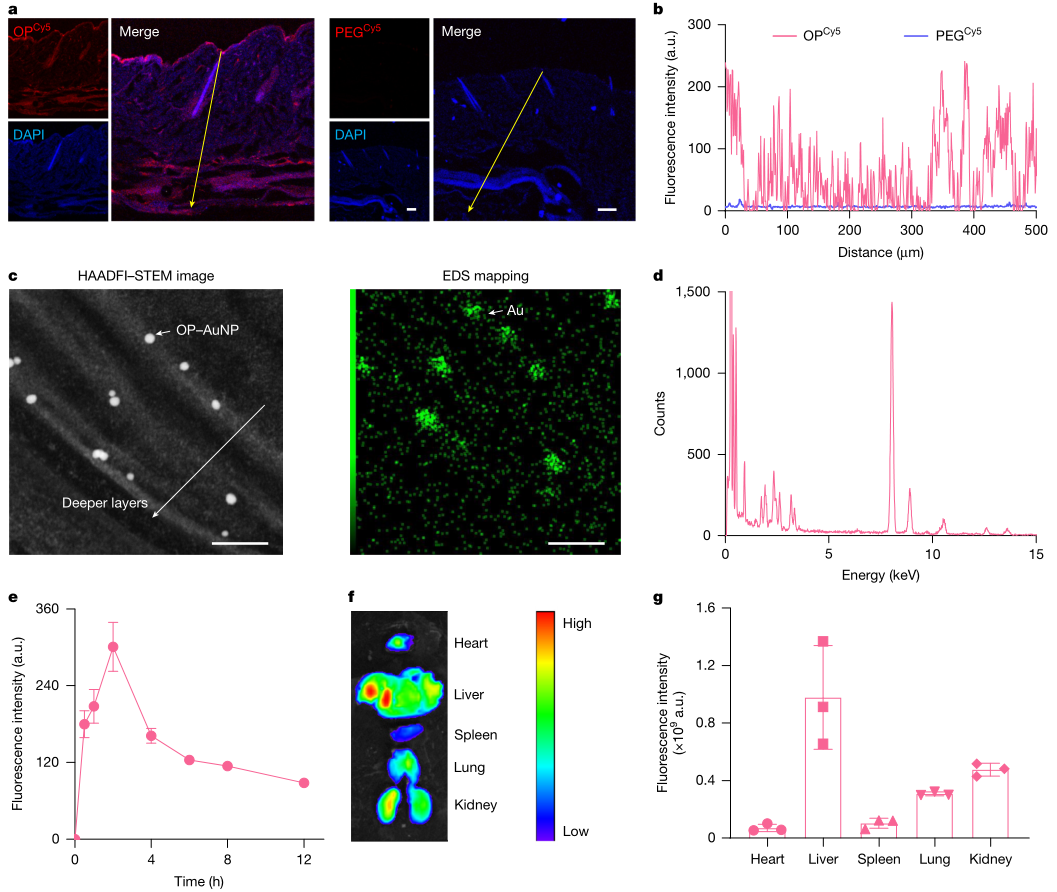
图1 OP的皮肤通透性
04
化学偶联、理化表征与受体结合
仅有载体能穿皮并不等同于药物可有效递送。为实现胰岛素的经皮输送,作者采用共价偶联策略制备OP–I。偶联化学选择应变促进叠氮-炔环加成(SPAAC):在胰岛素赖氨酸侧链引入叠氮基,在OP端基引入DBCO基团,两者无需铜催化即可快速反应生成稳定共价键,从源头降低金属催化对蛋白活性的潜在影响。对照体系为PEG化胰岛素(PEG–I),用于区分聚合物通用增溶/增稳效应与特定穿皮机制的贡献。
偶联产物的质量控制覆盖多个维度:采用RP-HPLC确认纯度与保留时间变化,用MALDI-TOF与GPC验证分子量与连接成功。功能层面,圆二色谱用于评估胰岛素二级结构是否发生明显改变,并通过体内注射降糖效果验证生物活性保留。受体相互作用方面,作者使用SPR测定与胰岛素受体ECD片段的结合动力学,给出OP–I与受体的Kd处于可接受范围,同时对IGF1R仍保持低结合倾向,降低非特异受体通路风险。为提供更细的结构解释,研究者进一步使用全原子分子动力学与PMF分析比较结合自由能与关键位点相互作用,形成对实验结果的计算支撑。
05
小鼠扩散池模型与小型猪乳膏给药的跨物种验证
在体内药效验证上,作者采用扩散池标准化给药面积与剂量,在STZ诱导的1型糖尿病小鼠中进行外用给药评估。实验设计强调可比性与剂量控制:限定入组血糖范围,尾静脉微量采血测血糖,扩散池面积固定,并设置多个剂量梯度。结果显示,外用游离胰岛素与PEG–I难以产生显著降糖,而OP–I表现出清晰的剂量依赖效应,在较高剂量下可在短时间内把血糖降至正常区间并维持较长时间。
为了进一步接近临床皮肤条件,作者在STZ诱导糖尿病小型猪中采用水包油乳膏作为外用载体,将OP–I按胰岛素当量分散后涂抹腹部皮肤并覆盖薄膜以减少外界扰动,血糖通过连续血糖监测系统实时记录。该部分实验提供跨物种的外用降糖证据,同时通过不同剂量组展示可调控性,使工作从小鼠有效推进到更具转化参考价值的验证层级。
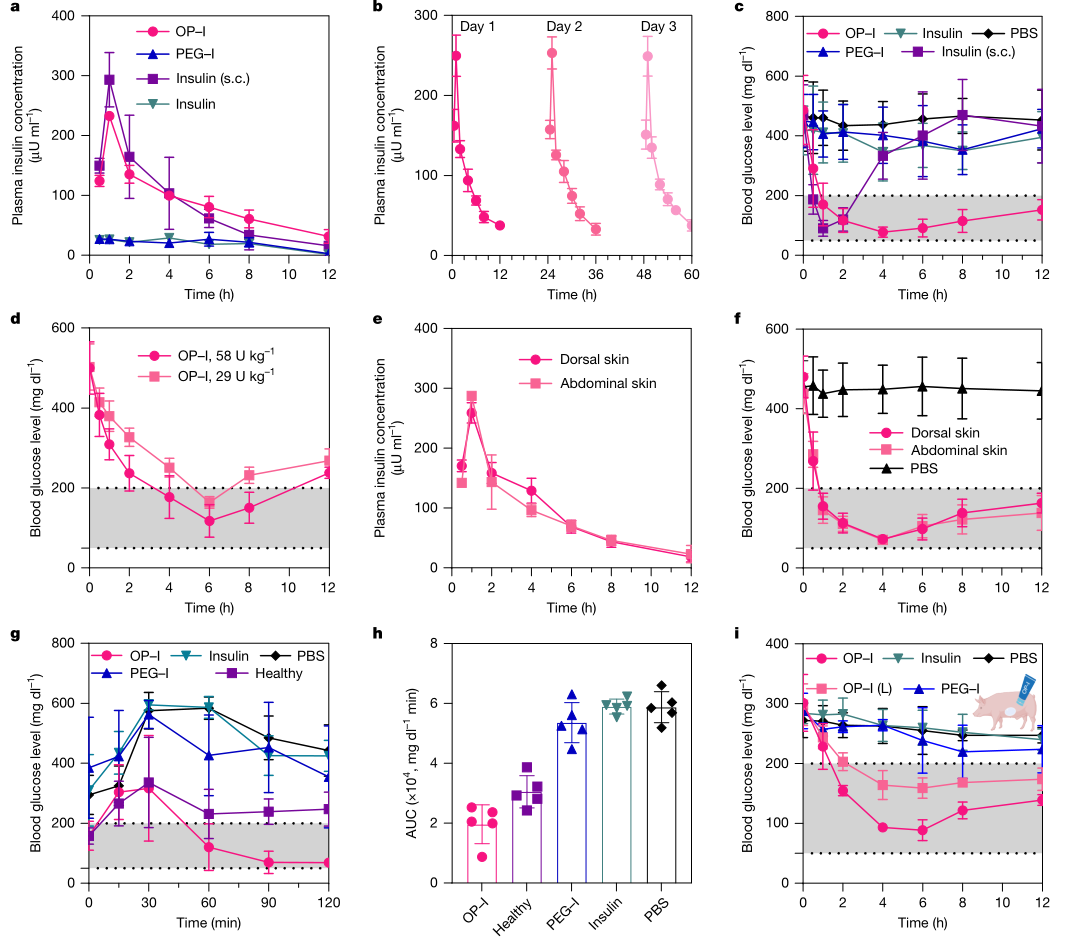
图2 OP–I外用在STZ诱导糖尿病小鼠与小型猪中的降糖效果
06
定量化外推:用3D皮肤等效模型把通透性参数化
为减少单纯动物实验的偶然性并建立可比较的通透性指标,作者引入3D皮肤等效模型EpiKutis。其构建包含在Transwell上培养角质形成细胞并进行气液界面诱导分化,形成分层结构后进行供体腔给药,受体腔定时取样并用ELISA定量渗透量。数据处理并非停留在绝对浓度,而是计算单位面积累积渗透量、稳态通量与表观渗透系数,将材料差异转化为可迁移的参数,为后续剂量推导与体系筛选提供更工程化的工具。
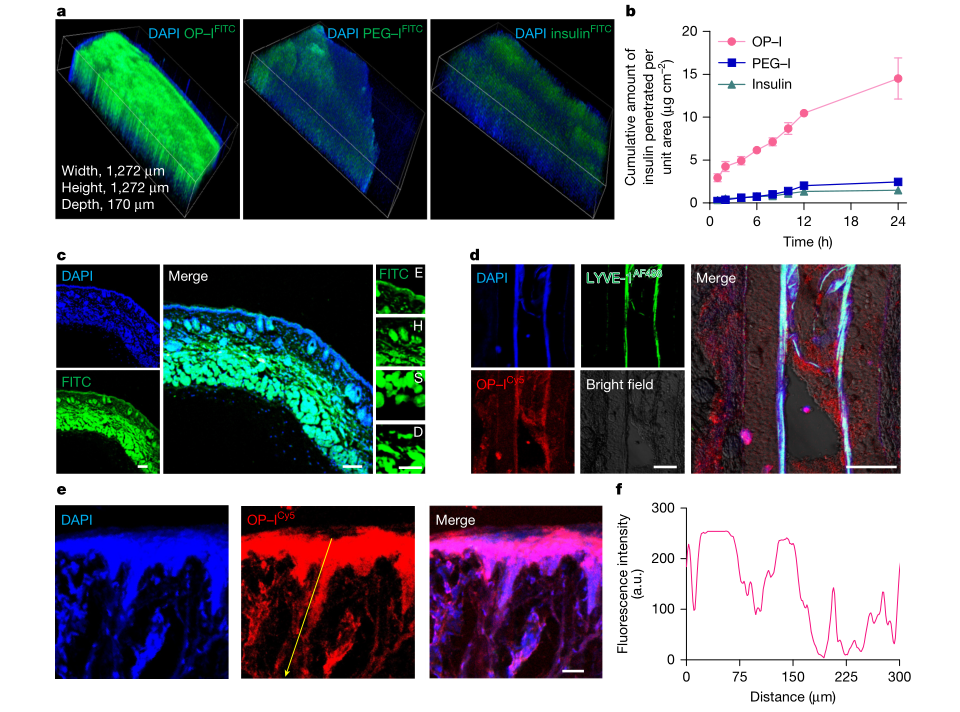
图3 OP–I的皮肤通透性
07
机制拆解:不依赖脂质层破坏,强调结合-扩散与膜介导迁移
在机制层面,作者刻意区分粗暴促渗与环境响应扩散。实验结果显示,OP与OP–I并未显著增加角质层脂质的流动性,提示其并非通过破坏脂质有序性来实现穿透。同时,简单物理混合(OP+胰岛素)并不能带来可比的穿透与降糖效果,共价偶联是获得有效递送的必要条件之一。计算模拟用于量化为什么更容易扩散。作者构建包含神经酰胺、胆固醇与脂肪酸的模型角质层脂质体系,比较OP、OP–I与胰岛素在脂质表面的吸附与扩散参数。结果给出沿脂质表面扩散的能垒与摩擦差异,OP与OP–I更低的能垒与更小的摩擦对应更快的界面扩散,并且在接近中性pH下转为聚两性离子状态后,静电束缚进一步降低,与皮肤pH梯度驱动的宏观机制相一致。
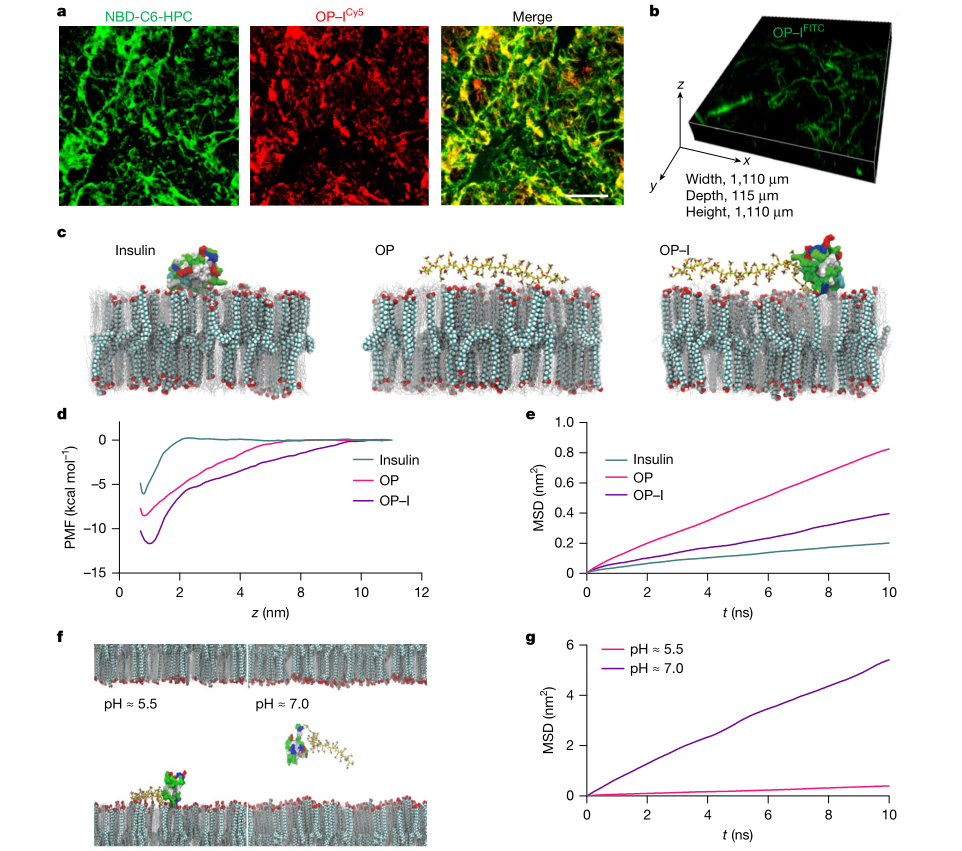
图4 OP与OP–I穿透角质层的机制研究
进入活体表皮后,作者用3D角质形成细胞球体结合TIRFM与共聚焦显微成像追踪OP–I的迁移方式。观察到OP–I主要定位于细胞膜并在膜上呈现可追踪的移动轨迹。细胞-细胞直接接触时会发生信号转移,而隔离细胞群并共享培养基则难以观察到转移,支持膜介导的细胞间迁移通路,并与减少胞内摄取从而降低降解的推断形成对应。最终,作者将该过程与真皮淋巴引流相联系,用于解释进入体循环的路径闭环。
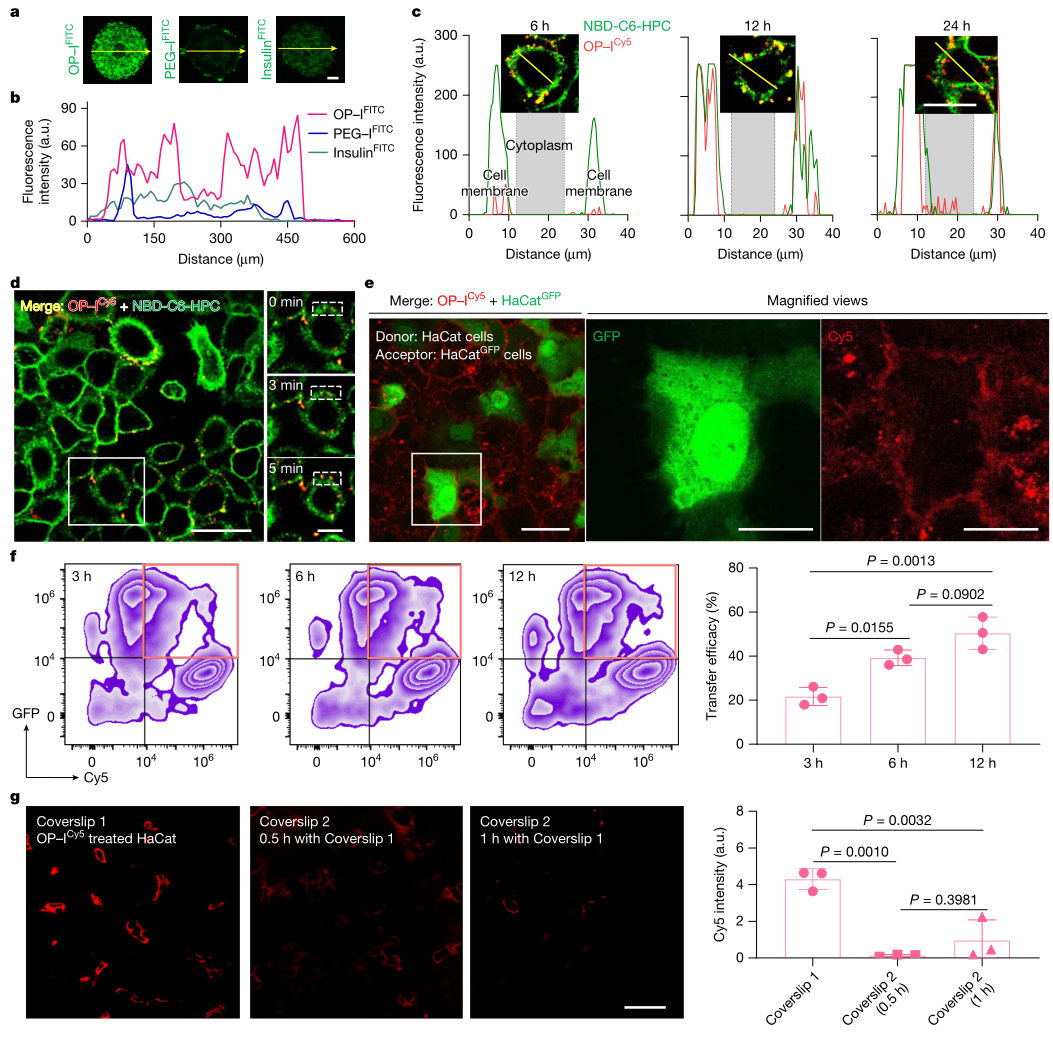
图5 OP–I在活体表皮中的渗透机制
08
安全性评估:组织学与细胞死亡检测的基本闭环
非侵入给药的底线是有效且不伤皮。作者采用SEM观察角质层微结构,用H&E评估组织学改变,并辅以TUNEL等方法检测细胞死亡信号。反复外用条件下未见明显角质层结构破坏、角质细胞脱落或炎症相关变化,也未观察到显著的细胞死亡信号,为短期安全性提供支撑。但从转化角度看,长期反复用药、敏感皮肤与病理皮肤状态下的系统评估仍是必须补齐的环节。
结论与前瞻
该研究的核心贡献体现在方法学闭环:通过pH响应电荷转变实现角质层富集与深层扩散,以纳米尺度成像定位穿越路径,用化学偶联把胰岛素转化为可穿皮构型并系统验证结构与受体功能,再以小鼠扩散池与小型猪乳膏给药完成跨物种药效验证,并辅以3D皮肤等效模型提供可量化通透性参数。这一组合让经皮递送生物大分子从概念讨论进入可重复验证的工程框架。面向临床转化仍需保持审慎:长期安全性边界、不同皮肤部位与人群差异导致的通透性波动校准、剂量控制与起效曲线的个体化设计、以及规模化合成与质量一致性如何满足药品监管要求,都是决定其能否真正落地的关键变量。若这些问题能被系统解决,这种环境响应型聚合物偶联策略具备向更多多肽与蛋白类药物扩展的潜力,为非侵入给药提供一条更可控的路径。