CUSTOMER
客户中心
助力生命健康领域从基础研究到产业化的加速转化
(一)造模机制
骨是乳腺癌等恶性肿瘤常见的远处转移部位。乳腺癌骨转移动物模型的建立主要采用接种方法,即用动物或人类乳腺癌细胞株,通过原位或异位种植产生的动物模型。部分模型除用于模拟人类骨转移的骨质破坏外,还可模拟癌疼痛引起的神经化学功能紊乱及行为学特征,同时作为疼痛动物模型使用。造模是否能够成功与肿瘤细胞的生物学特性、接种部位及接种动物的免疫功能等因素有关。此外,还可在自发或诱导的乳腺癌动物模型上出现骨转移,但此类方法由于骨转移发生率低、成瘤时间过长及伴有多脏器转移等原因不适用于骨转移的研究。
(二)造模方法
1.局部骨髓腔内注射
(1)裸鼠模型:肿瘤细胞采用MDA-MB-231或MDA-MB-435 细胞,造模前用PBS调节成浓度1X107个/毫升的细胞悬液。动物采用雌性 BALB/c-nu/nu 裸鼠,将裸鼠麻醉后,用19G的针尖直接于骨性粗隆上刺透骨皮质,然后将针尖插入骨干内注入0.1ml的单细胞悬液,可将对侧注入同量的生理盐水作为对照。Kjonniksen 等首次报道用该方法在裸大鼠胫骨直接穿刺成功制作了骨转移模型。Wang等报道,将 MDA-MB-435细胞直接注入裸小鼠股骨干成功地形成了骨转移。约在接种后第2周可在髓腔内发现肿瘤组织,于第3周所有的动物髓腔均有肿瘤组织,于第4周发现有骨皮质及周围软组织的浸润。
(2)大鼠模型:由于裸鼠骨髓腔空间较小,接种操作难度较大。Medhurst 等通过在大鼠胫骨接种肿瘤细胞的方式建立了大鼠乳腺癌骨转移/骨癌痛模型,中日友好医院谭煌英教授在国内对该模型进行了成功复制。
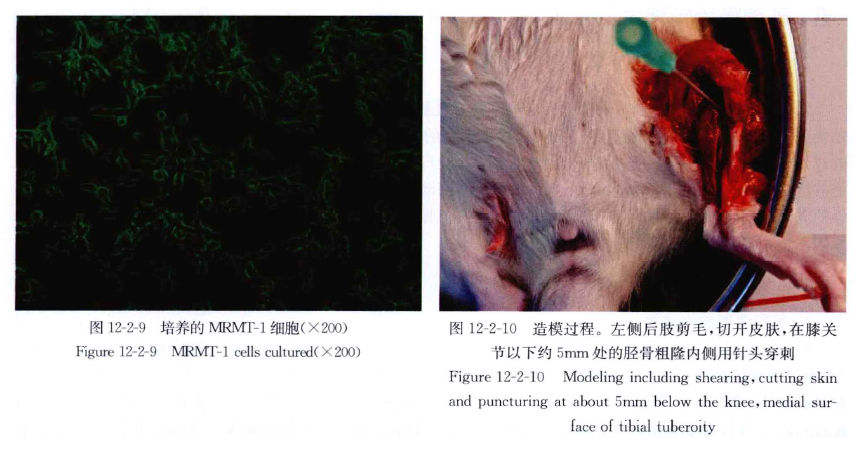
造模采用大鼠乳腺癌 MRMT-1细胞,完成传代培养后,在造模前配制成浓度1X106/ml的细胞悬液,置于冰上备用。动物选用雌性 SD大鼠,体重 150~200g。动物麻醉后,腹部朝上,左侧后肢剪毛,皮肤消毒,在胫骨上段皮肤切开1cm 小口,在膝关节以下约5mm处的胫骨粗隆内侧面用21G或22G针头(BD 公司)穿刺打孔,针头穿透骨皮质进入骨髓腔后,用微量注射器将 3μl配制好的癌细胞悬液(细胞数约为 3 X 103个),注射于大鼠骨髓腔内,撤出微量注射器后迅速用骨蜡(在50~52℃水浴中保温)密封针孔,以防癌细胞悬液从骨髓腔溢出。然后,以无菌棉签蘸生理盐水清洗创口,皮肤缝合。
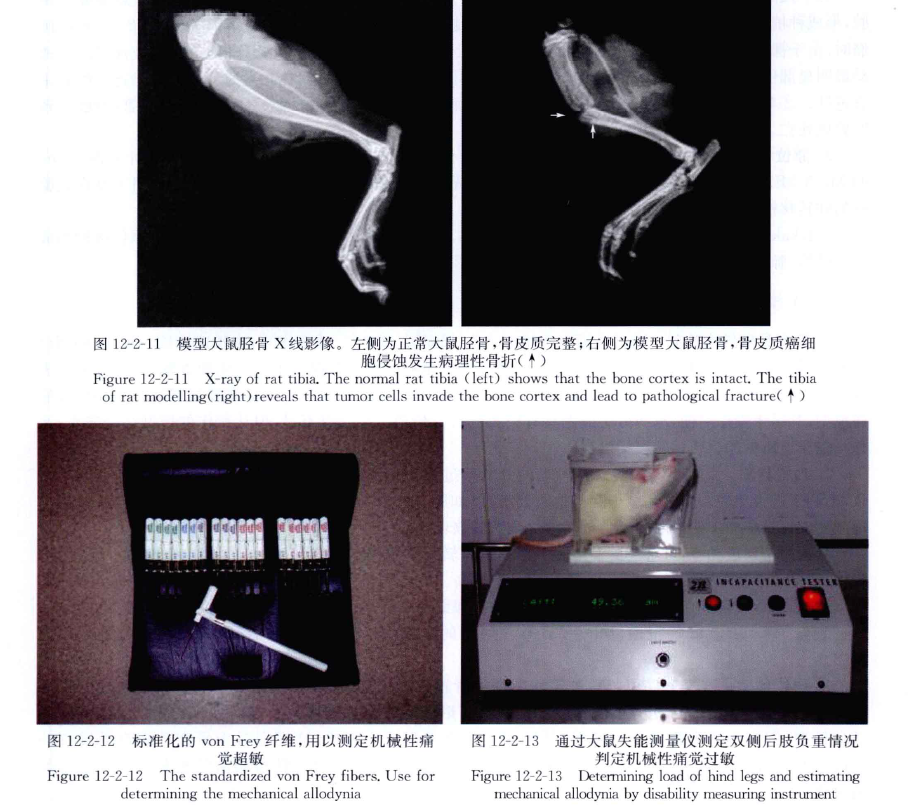
接种 10~14天时X线影像显示,骨皮质和骨小梁受损,20天后出现明显骨质破坏,严重的可能出现病理性骨折。同时,骨矿物质含量和骨密度明显下降。通过对病变胫骨脱钙后切片进行染色。H-E染色可以观察到各组大鼠胫骨组织的形态变化:骨髓腔内和骨皮质外大量肿瘤细胞浸润,排列紊乱,胫骨皮质连续性中断,甚至完全被肿瘤组织所取代,骨皮质与周边的骨样组织和(或)编织骨相移行,具有混合性骨质破坏的特征。抗酒石酸酸性磷酸酶染色(TRAP)显示,病灶内有大量具有破骨细胞特征的多形核细胞增生。随着肿瘤的生长,大鼠活动性逐渐降低,12~14天后表现出具备机械性痛觉超敏,机械性痛觉过敏和热痛觉过敏的特点(图12-2-9~图 12-2-14)。
2.血行转移 左心室注射法是目前较广泛使用的一种骨转移制作方法,Arguello等首先报道采用这种方法制作裸鼠骨转移模型,其后经多方改进,目前的方法如下:
将人乳腺癌细胞株 MDA-MB-435加入新鲜 RPMI1640培养基和10%新生牛血清,放入 37℃ CO2培养箱中培养,待培养瓶中细胞 80%~90%融合时传代培养,使用前将贴壁细胞吹打成单细胞悬液,1500r/min离心6分钟。PBS调整细胞悬液浓度为2X107/ml,置于冰盒中待用。将雌性 BALB/cA-nu/nu裸鼠(体重20~25g,6~8周龄)麻醉后,75%酒精前胸壁消毒,用手触及心尖搏动最明显处,约于胸骨左旁 3mm 第二肋间,瞄准正中垂直进针,回抽,若能看到有鲜红的血液抽出,则表示针已进入左心室,将细胞悬液 0.2ml慢慢推入后,迅速拔针,用棉球稍压针孔。一般而言,用MDA-MB-231及 MDA-MB-435细胞能使 30%~90%的动物形成骨转移。

为了提高造模成功率,操作时应注意以下几点:①进针时若把握不好,深度可能导致细胞悬液漏至胸腔,形成种植肿瘤,而不是转移肿瘤,进针深度一般不超过 6mm 比较好。②心脏的固定及进针位置:种植肿瘤时,由于裸鼠心脏较小且容易滑动,会导致多次进针但刺不中心脏的情况。操作时,应在触及裸鼠心尖搏动最明显部位后,让助手向左轻推裸鼠的胸壁,起到固定心脏的作用,然后在心尖搏动明显略靠近中线处垂直进针。③单细胞悬液的细胞浓度要恰当,过高的细胞浓度常引起细胞成团块,引起心脏或血管的梗阻,致实验鼠死亡。
3.原位种植 将裸小鼠麻醉后,在胸侧的皮肤上作一 5mm切口用于暴露脂肪垫,用 27G针尖将 0.1ml的 MDA-MB-435单细胞悬液准确注入脂肪垫内,每周测量接种部的直径。这种方法更加常用于制作乳腺癌的肺转移模型。
Lelekakis 等报道用自发于 BALB/cfC3H小鼠的乳腺癌细胞系4T1及4T12进行细胞系原位接种形成了骨转移、肺转移,这是首次报道有自发性骨转移的形成。
(三)模型特点
1.局部骨髓腔内注射 这种造模方法相对简单、周期短、成本低、成瘤率高、生长速度较一致、转移部位明确,一般不会因肿瘤转移至其他脏器对实验结果产生影响。缺点是损伤了骨皮质和骨髓腔,而且主要表现为骨干的转移,与临床上常见的骨骺端转移有所不同。有学者认为,胫骨癌症痛模型可视为转移性骨癌痛模型,其手术操作简便,测痛方法成熟具有较大的研究价值。尽管有不足,但从所作的模型结果来看,还是与临床上所见的骨转移状况相类似。
2.血行转移 此模型与人类恶性肿瘤的骨转移过程较为接近,缺点是骨转移瘤部位和生长速度不一致,不利于进行羥帔法执较;此外,还会引起其他重要脏器(如脑、肺、肾上腺皮质等部位)转移,导致某些实验鼠出现截瘫或骨转移尚不明显时因其他的转移灶全身播散衰竭死亡。
为提高造模成功率,并解决肿瘤细胞引起多器官转移这个问题,有研究者通过筛选骨靶向性亚克隆细胞株,使肿瘤细胞的骨转移能力增强,造模成功率提高。Yoneda等将亲代的 MDA-MB-231细胞注入裸鼠左心室后,引起骨转移的组织于体外扩增筛选,再注入裸鼠左心室,如此反复几个循环后,即可获得 MDA-231B亚克隆。Wetterwald等报道,MDA-231-B注射后的全部裸鼠发生了骨转移,而极少出现其他部位的转移。
3.原位种植 该模型保留了从肿瘤原发灶到骨转移的完整过程,对研究乳腺癌骨转移发生的机制提供了较好的手段。理论上,小鼠乳腺癌细胞系所形成的原位骨转移模型是与临床状况极为相似的骨转移模型,因为小鼠为非免疫缺陷鼠,骨转移均为自发形成。因此,该模型对于研究乳腺癌骨转移的形成机制及各种细胞因子在骨转移形成过程中的作用或细胞因子对骨转移的治疗机制均有极其重要的价值。
该模型的缺点与血流播散制作骨转移模型相似,主要是于骨转移的发生率偏低,且会伴有多个重要脏器的转移。其成功率甚至明显低于血液播散,而更无法与骨内注射模型的骨转移相比。