SERVICE
技术服务
高质量的数据和快速的周转期以支持各项药物开发、临床前研究和临床研究
概述
铁死亡(Ferroptosis)由Dixon在2012年首次提出的一种新的细胞死亡。与自噬和细胞凋亡不同,铁死亡是一种铁依赖性和活性氧(ROS)依赖性的细胞死亡,其特征主要是细胞学变化,包括线粒体嵴减少或消失、线粒体外膜破裂等。这些细胞异常是由于强烈的膜脂质过氧化和氧化应激的发生导致质膜选择性通透性丧失引起的。
铁死亡机制
铁死亡的调控途径大致可分为三类:(1)受谷胱甘肽(GSH)/谷胱甘肽过氧化物酶4(GPX4)通路调控,如抑制系统Xc-、硫转移通路、MVA通路、谷氨酰胺通路等。(2)铁代谢的调控机制,如与铁蛋白代谢相关的ATG5-ATG7-NCOA4通路和IREB2的调控,以及p62-Keap1-NRF2和HSPB1的调控通路都对铁死亡有影响。(3)脂质代谢的相关通路,如P53-SAT1-ALOX15、ACSL4、LPCAT3等,氧化脂质,产生大量ROS,从而促进铁死亡。此外,FSP1-CoQ10-NAD(P)H通路作为一个独立系统存在,与GPX4和谷胱甘肽协同作用以抑制磷脂过氧化和铁死亡(图1)[1]。(https://pubmed.ncbi.nlm.nih.gov/32015325/)
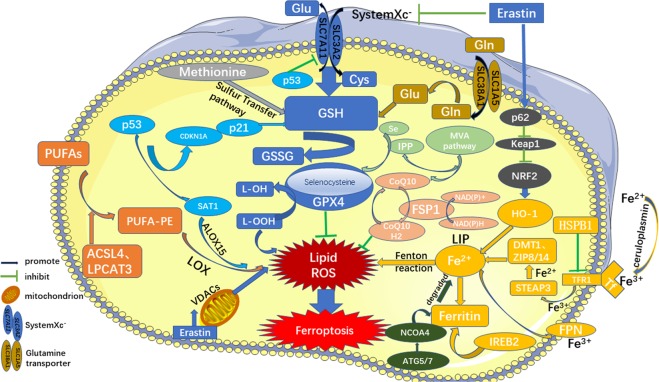 图1 铁死亡机制[1]
图1 铁死亡机制[1]
铁死亡在肿瘤治疗的双重性
铁死亡作为一种特殊的病理细胞死亡方式,与多种疾病紧密相关,包括退行性疾病(如阿尔茨海默病、帕金森病)、创伤性脑损伤、缺血再灌注损伤、肾脏变性,以及肿瘤。其在肿瘤治疗中的双重性特征,既为科研人员带来了挑战,也揭示了新的治疗策略。
在肿瘤的发展及抗肿瘤免疫过程中,铁死亡扮演着至关重要的角色。研究发现,在某些模型中,铁死亡能够抑制肿瘤生长,而在另一些模型中则可能促进肿瘤的发展。具体而言,CD8+T细胞通过释放IFNG,激活STAT1通路,进而抑制癌细胞中的SLC7A11表达,导致肿瘤细胞发生铁死亡(见图2a)。然而,铁死亡过程中释放的损伤相关分子(DAMP)可能通过维持炎症性的肿瘤微环境,反而促进肿瘤的生长。以KRASG12D蛋白为例,它是铁死亡癌细胞释放的一种DAMP。癌细胞释放的KRASG12D蛋白能够激活STAT3通路,增加M2型巨噬细胞的极化,从而推动肿瘤的生长(见图2b)[2-3]。
因此,深入研究铁死亡在不同疾病中的作用机制,对于开发新型靶点药物具有重要意义。通过精确调控铁死亡过程,有望为肿瘤治疗提供一种全新的思路和方法。这不仅有助于提高治疗效果,也可能为患者带来更低的副作用和更好的生活质量。(https://pubmed.ncbi.nlm.nih.gov/33268902/)(https://pubmed.ncbi.nlm.nih.gov/33514910/)
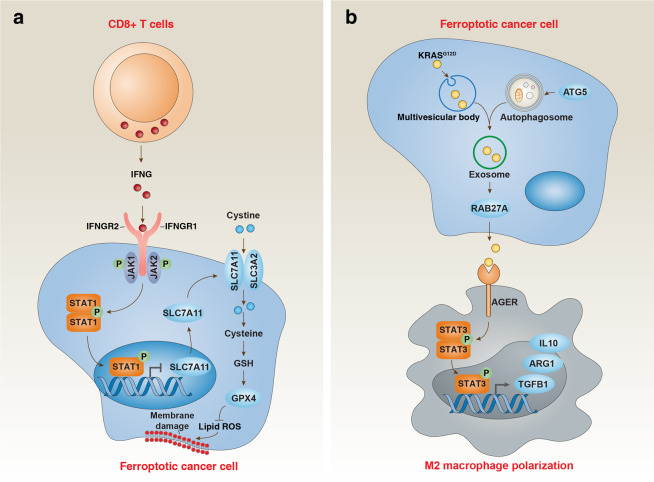 图2 铁死亡在肿瘤免疫中的双重影响[2]
图2 铁死亡在肿瘤免疫中的双重影响[2]
参考文献:
[1] Li J, Cao F, Yin HL, Huang ZJ, Lin ZT, Mao N, Sun B, Wang G. Ferroptosis: past, present and future. Cell Death Dis. 2020 Feb 3;11(2):88. doi: 10.1038/s41419-020-2298-2. PMID: 32015325; PMCID: PMC6997353.
[2] Tang D, Chen X, Kang R, Kroemer G. Ferroptosis: molecular mechanisms and health implications. Cell Res. 2021 Feb;31(2):107-125. doi: 10.1038/s41422-020-00441-1. Epub 2020 Dec 2. PMID: 33268902; PMCID: PMC8026611.
[3] Chen X, Kang R, Kroemer G, Tang D. Broadening horizons: the role of ferroptosis in cancer. Nat Rev Clin Oncol. 2021 May;18(5):280-296. doi: 10.1038/s41571-020-00462-0. Epub 2021 Jan 29. PMID: 33514910.