CUSTOMER
客户中心
助力生命健康领域从基础研究到产业化的加速转化
这篇围绕几类用得特别多的免疫系统疾病模型,梳理一个实操向的“造模方法地图”,方便读者一边看一边对照自己课题:
(1)血管炎代表:川崎病小鼠冠状动脉炎模型;
(2)关节炎代表:类风湿关节炎大鼠模型(佐剂诱导AA、胶原诱导CIA);
(3)系统性自身免疫代表:Pristane诱导系统性红斑狼疮SLE小鼠模型。
01川崎病模型
川崎病的核心问题是中小血管炎,尤其是冠状动脉的炎症和重塑,所以如果你的课题关键词里有“儿童血管炎”“冠状动脉炎症”“免疫介导心血管损伤”,这个模型基本就是必看选项。
常用做法是用酪乳杆菌细胞壁成分LCWE诱导小鼠冠状动脉炎。选择6周龄左右雄性C57BL/6小鼠,按体重计算剂量腹腔注射LCWE(例如0.5 mg/kg,每日一次,连续给药若干天)。之后可以在冠状动脉周围看到明显的炎性细胞浸润、外膜纤维增生甚至管壁结构改变,从病理形态上很接近川崎病相关冠状动脉炎。
模型适用领域
(1)川崎病、儿童血管炎的发病机制;
(2)免疫炎症介导的冠状动脉损伤、血管重塑;
(3)抗炎药物、免疫调节药物对冠状动脉炎症的干预评价;
(4)想把“血管炎→心血管并发症”这条链路讲清楚的课题。
注意事项
(1)LCWE的制备、乳化方式和批次稳定性会直接影响造模成功率。
(2)品系和性别尽量不要随意更换。
(3)终点评价不要只看病理切片,要结合心脏和大血管病理结合血清炎症因子(比如IL-6、TNF-α)一起看。
02类风湿关节炎模型
类风湿关节炎是免疫系统动物模型里出镜率非常高的一类。做慢性炎症、骨破坏、自身免疫、抗炎镇痛,基本绕不开它。常用的有两条路线:佐剂诱导关节炎(AA)和胶原诱导关节炎(CIA)。
(一)佐剂诱导关节炎(AA)
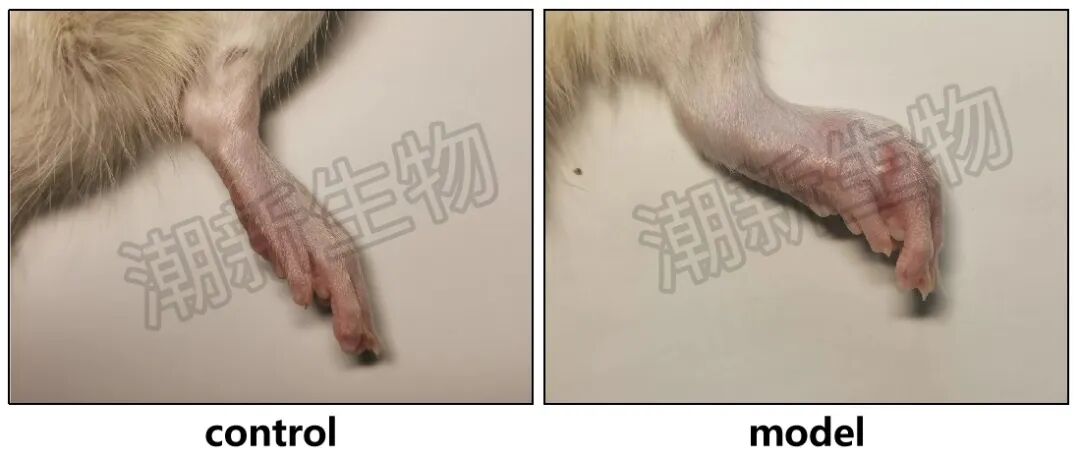
用弗氏完全佐剂CFA在大鼠足跖局部注射,诱导全身炎症和关节炎。选用7周龄雄性Wistar大鼠,在右后足跖皮内单次注射一定体积的CFA。之后大鼠逐渐出现踝关节红肿、疼痛、活动受限,病理上可见滑膜炎症、血管扩张、炎性细胞浸润,以及软骨、骨质逐步破坏。
AA模型特点
(1)造模快,炎症反应强烈,关节红肿非常直观,适合做抗炎、镇痛、抗骨破坏的药效学评价。
(2)免疫特异性相对“粗”,更像一个“严重慢性炎症+关节损伤”模型。如果你的研究重点是整体抗炎效果,这条路足够用了。
(二)胶原诱导关节炎(CIA)
CIA模型是围绕Ⅱ型胶原的自身免疫反应来设计的,更接近人类RA的免疫机制。
造模一般分以下几步:
第一步:制备Ⅱ型胶原乳剂
把牛Ⅱ型胶原溶于稀冰醋酸中,配成一定浓度的胶原溶液,在4℃条件下缓慢搅拌过夜让其充分溶解。
第二天放在冰浴中,加入等体积弗氏完全佐剂CFA,充分乳化。常用判断标准是:乳剂滴入水中仍保持团块状而不散开。
第二步:初次免疫
选用7周龄雄性Wistar大鼠,在距尾根约2 cm处,尾部皮下注射一定体积胶原乳剂。
第三步:加强免疫
初免后第7天再次免疫,这次将佐剂换成弗氏不完全佐剂IFA,注射部位改为距尾根约3 cm处尾部皮下,体积略小。
之后两到三周内,大鼠会逐渐出现双侧对称多关节肿胀、疼痛,病理上表现为滑膜增生、炎性浸润、软骨侵蚀、骨破坏。同时可以检测到针对Ⅱ型胶原的自身抗体以及相关T细胞反应,免疫学特征和人RA更接近。
CIA模型适用领域
(1)研究RA的自身免疫机制:T/B细胞亚群、抗原呈递、细胞因子网络。
(2)各类免疫靶向药物、生物制剂、小分子抑制剂的评价。
(3)诱导免疫耐受、长期干预、联合用药等,需要“免疫层面故事”比较完整的课题。
AA和CIA选用意见参考
(1)更关注抗炎镇痛和整体关节保护可以选择AA模型。
(2)研究重点是自身抗原、淋巴细胞、抗体谱,想要围绕免疫进行讨论,那就优先CIA。
大鼠类风湿性关节炎
03系统性红斑狼疮(SLE)
选用8周龄左右的雌性BALB/c小鼠,单次腹腔注射一定体积的Pristane(常见为0.5 mL/只)。之后在数月内,小鼠逐渐出现多种自身抗体升高,比如抗核抗体ANA、抗双链DNA抗体anti-dsDNA、抗nRNP/Sm抗体、抗单链DNA抗体anti-ssDNA等,这些指标和人类SLE的自身抗体谱高度相似。
随着病程进展,小鼠会出现蛋白尿、肾功能异常,肾脏病理可见典型狼疮性肾炎改变,免疫荧光下可看到免疫复合物沉积。
模型适用领域
(1)系统性自身免疫病的发病机制研究,尤其是自反应B细胞活化、抗体谱演变、免疫复合物沉积。
(2)各类免疫抑制剂、生物制剂、新型小分子的长期干预与安全性评价。
(3)狼疮性肾炎相关课题:从肾损伤机制到干预策略。
模型的一个现实问题是:周期长,造模到典型表现出来往往要几个月,时间成本比较高,但换来的好处是可以做长周期、慢病型的设计。
04免疫系统模型选型
很多实验室掉坑,其实不是模型选错,而是细节没想清楚。几个容易被忽略、但很关键的点:
(1)物种和品系
C57BL/6、BALB/c、Wistar、SD之间的免疫背景差得离谱:炎症反应强度、易感性、免疫谱都不一样。文献写得很清楚用的是哪一类,就尽量别擅自改。
(2)性别和年龄
自身免疫病模型里,雌性通常更易感。年龄一般锁定在6~8周,太小免疫系统不成熟,太大基础问题更多,模型波动会更大。
(3)造模试剂和操作细节
LCWE、Ⅱ型胶原、Pristane这些关键材料,纯度、批次、保存方式都会改结果。乳剂是不是稳定、尾部注射的具体位置、冰浴乳化时间这类细节,建议全部写进SOP。
(4)终点评价尽量做成一个“组合包”
免疫相关模型,单一指标的文章天花板很有限。更推荐的配置是:
结构层面:器官指数、关节或肾脏病理。
功能层面:关节临床评分、活动度、蛋白尿、肾功能等。
免疫层面:细胞因子、流式分群、自身抗体谱。
组合起来,故事就完整多了,也更容易往高分期刊去靠。
05动物造模的时间和精力怎么分配更划算
对很多课题组来说,真正卡住的往往不是“找不到模型方案”,而是:
(1)造模周期长,操作琐碎,一不小心一批失败就是好几个月白干。
(2)人手有限,要同时管饲养、造模、给药、采样、检测,很难把每一环都做到稳定。
(3)想搭一整套“免疫+病理+功能”的评价体系,结果日常操作太耗费精力。
一个相对理性的思路是:先把自己的课题逻辑构好,明确疾病类型、关键通路、主要终点,然后再决定:哪些环节自己做更有价值(比如机制部分、关键检测方法),哪些环节交给有成熟SOP的团队做更划算(比如标准化造模、基础终点评价)。
像川崎病冠状动脉炎小鼠模型、AA/CIA类风湿关节炎大鼠模型、Pristane诱导SLE小鼠模型这几类,其实都已经有比较成熟的造模流程和评价体系。你完全可以在这个基础上往前推半步、往后拉半步,把自己的创新点放在机制挖掘、靶点验证、联合用药策略上,把时间和精力从重复的“体力活”里抽出来。
免疫系统相关课题里,动物模型不是“有没有”的问题,而是“选哪一个、做到什么颗粒度”的问题。模型选清楚,造模细节抓稳,为写文章和答辩打好基础。