CUSTOMER
客户中心
助力生命健康领域从基础研究到产业化的加速转化
01神经和肿瘤之间,到底在传递什么?
在多种实体瘤里,病理医生反复看到同一个现象:肿瘤内部神经越密集,病人的预后越差,转移发生得越积极。神经和肿瘤之间显然有某种“互相成就”的关系,但过去大多数讨论停留在信号分子、神经营养因子这些层面,很难解释为什么去神经后肿瘤的生长和转移会受到如此明显的影响。这篇 2025 年发表在 Nature 的工作,给出了一个非常直观的答案:癌细胞会从神经元那里获取线粒体,而这批拿到“神经来源线粒体”的癌细胞,在代谢能力、应激耐受性以及远处转移潜能方面,都明显优于同一肿瘤中的其他细胞。
02去神经之后,肿瘤的能量代谢明显受损
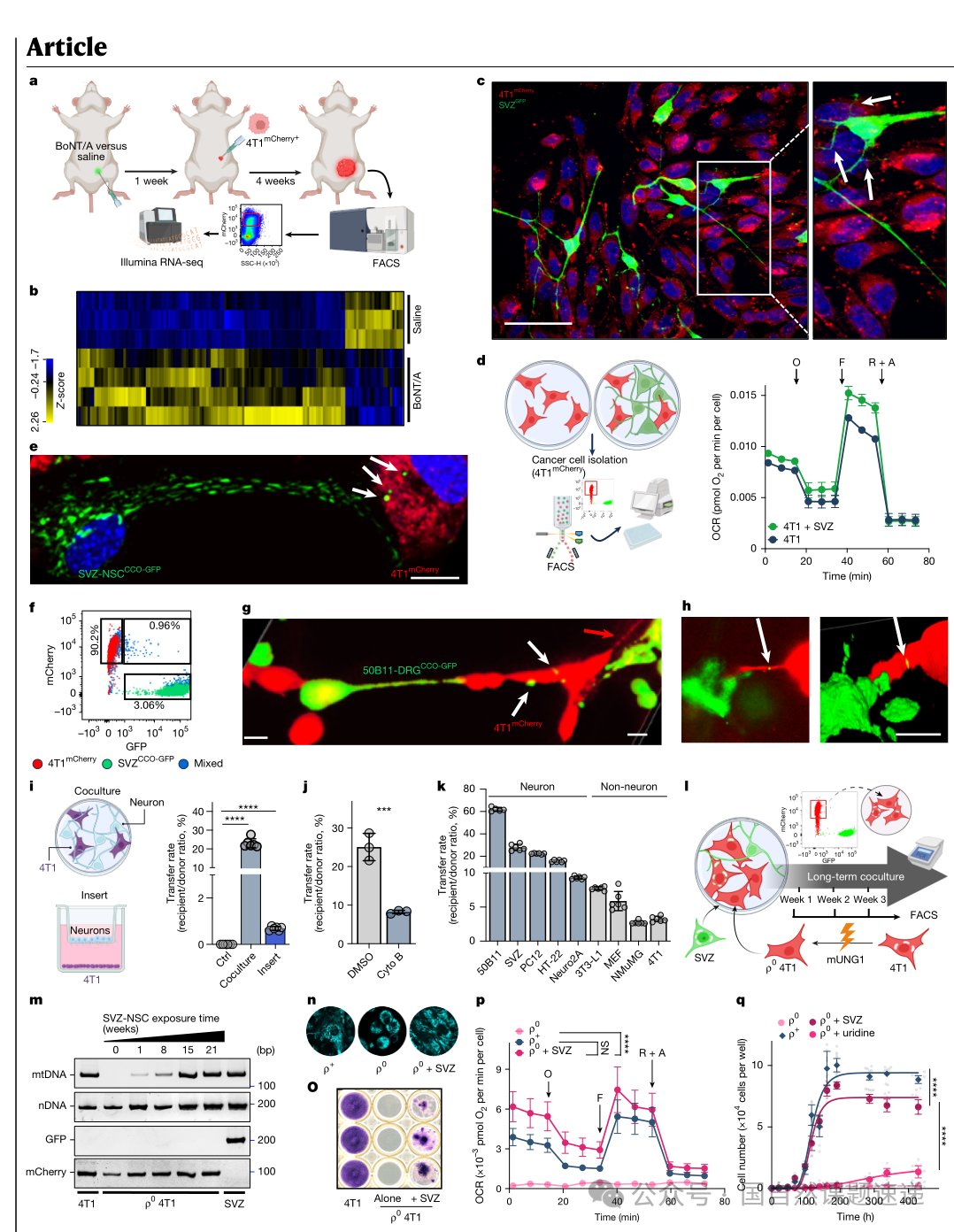
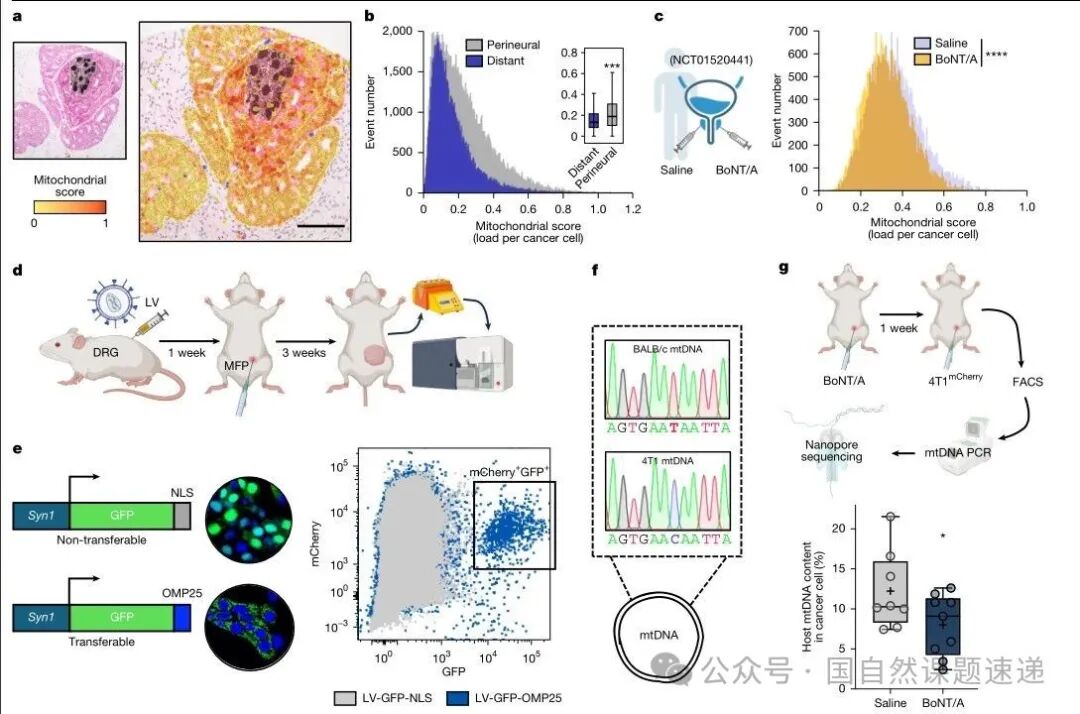
作者首先用化学去神经模型验证神经对肿瘤代谢的影响。无论是在小鼠三阴性乳腺癌的4T1模型,还是在人源导管原位癌的异种移植模型中,局部注射肉毒毒素A型阻断神经输入之后,从肿瘤中分选出来的癌细胞在转录组层面都出现了非常明确的变化:线粒体相关代谢过程整体下调,三羧酸循环通路受到显著抑制,肿瘤细胞更倾向于依赖糖酵解供能。对应到病理层面,去神经组中出现侵袭性病灶的比例明显下降,提示神经输入不仅影响肿瘤的生长速度,也直接关系到病灶是否能够突破原位,向更恶性的阶段演进。
03神经不只是“在旁边”,而是把线粒体直接交给了癌细胞
神经参与下肿瘤线粒体功能提升的现象本身并不罕见,但这篇文章关键的一步在于进一步追问:神经是不是只在提供可溶性因子,还是已经发展到“连线粒体都一起转移”的程度。为此,作者用遗传标记的方式分别标记神经元和癌细胞:神经元线粒体被标记为 GFP 阳性,癌细胞整体表达 mCherry 红色荧光。在共培养体系中,既有 GFP 又有 mCherry 的双阳性癌细胞不断出现,说明它们获得了来自神经元的 GFP 阳性线粒体。三维共聚焦成像可以清楚看到类似“隧道纳米管”的细胞间细长结构,线粒体沿着这些结构在神经元和癌细胞之间移动,提供了形态学上的直接证据。
04MitoTRACER:让“接受过线粒体的细胞”在肿瘤演化过程中始终可见
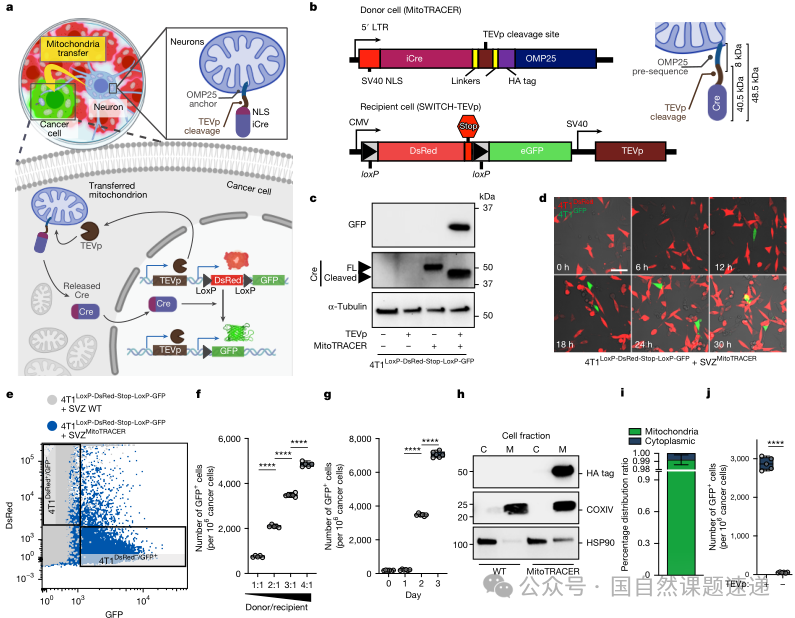
传统的 GFP 线粒体标记有一个根本限制:只能捕捉到某一时间点正在发生或刚刚发生的线粒体转运,随着细胞分裂和线粒体更新,信号会逐渐减弱或消失,很难追踪这些细胞在后续几周甚至更长时间里的命运。作者为此设计了一个名为 MitoTRACER 的遗传标记系统,使一次线粒体转运事件可以触发一个不可逆的荧光开关。
这个系统的构造思路是:在神经元一侧,将 Cre重组酶锚定在线粒体外膜上,同时带有核定位信号和TEV蛋白酶识别位点;在癌细胞一侧,预先放入一个DsRed→GFP的loxP开关,并表达特异的TEV蛋白酶。当神经元线粒体连同线粒体外膜上的Cre进入癌细胞后,TEV会切去前段,使Cre获得进入细胞核的能力,随后Cre在细胞核中切除DsRed片段,激活下游GFP的表达。这样一来,任何一次成功的线粒体转移都会把受体癌细胞从“红色”永久切换为“绿色”,而这种状态将稳定地在细胞分裂过程中传给后代。
05接受神经线粒体的癌细胞,代谢和性状全面偏向“转移种子”
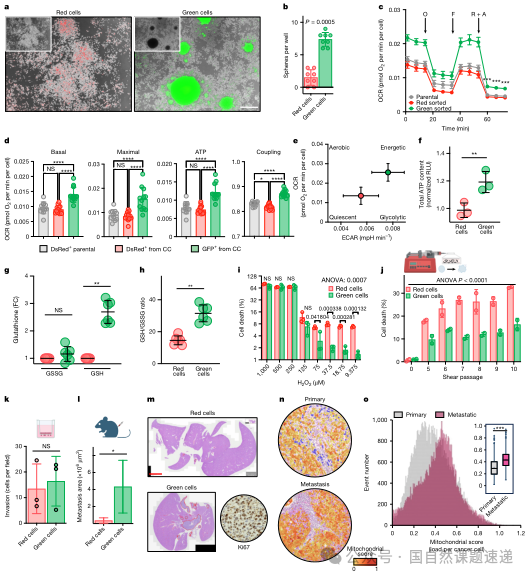
有了稳定的标记工具,作者就可以把“接受过线粒体的细胞”和“从未接受过的细胞”分开研究。在 MitoTRACER 共培养后,研究者通过流式分选分别收集绿细胞和红细胞,再进行平行的功能分析。结果显示,绿细胞在不依附基底的条件下更容易形成球状团块,这种锚着独立生长能力常被视为肿瘤干性和转移潜能的一个重要表征。用标准的乳腺癌 mammosphere 体系测试时,绿细胞形成的球数和大小都显著高于红细胞,进一步支持了它们具备更强的“干样”特征。
从代谢角度看,绿细胞的基础呼吸、最大呼吸和 ATP 产生水平均高于红细胞和原始 4T1 细胞。如果同时考虑氧耗与糖酵解水平,可以看到绿细胞整体处在“有氧且能量储备充足”的象限。这意味着它们不仅能在氧化磷酸化路径上高效运转,也有能力根据环境应变。抗应激方面,绿细胞的还原型谷胱甘肽含量上升,GSH/GSSG 比值更高,对过氧化氢等氧化应激的耐受性明显增强,在模拟血流剪切力的实验条件下存活率也更高。换句话说,这一小群接受过神经线粒体的癌细胞在面对氧化压力和机械压力时,更难被“淘汰出局”。
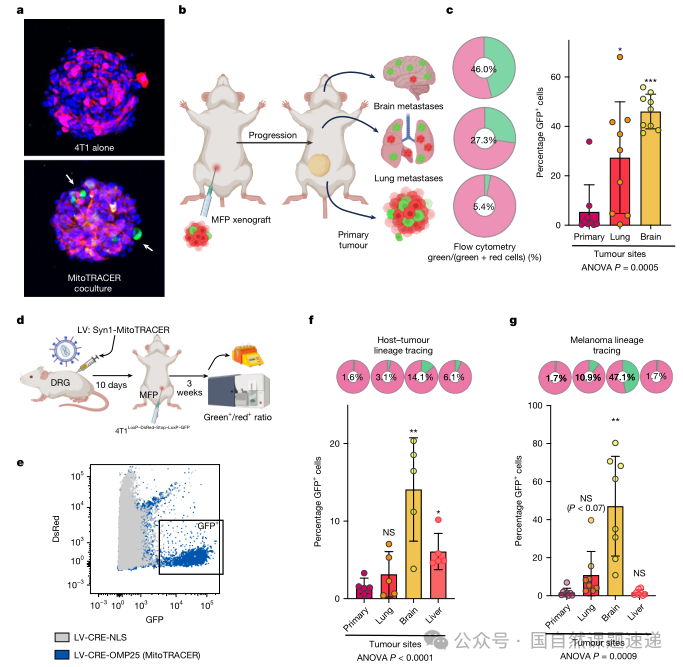
06在小鼠体内,绿色细胞更容易出现在远处转移灶
要证明这些性状差异在体内转移过程中是否真正“说话”,作者做了两套命运追踪实验。第一套是将已经在体外共培养形成的混合球体植入小鼠乳腺脂肪垫,这些球体中同时含有红细胞和已经变绿的细胞。随着肿瘤在体内生长并发生转移,研究者分别从原发灶、肺组织和脑组织中分离出癌细胞,通过流式检测其中绿细胞的比例。在原发肿瘤中,绿细胞约占总癌细胞的 5%,比例并不算高;但在肺转移灶中,这一比例上升到接近四分之一,在脑转移灶中甚至接近一半。也就是说,虽然在肿瘤起点阶段接受神经线粒体的只是少数,但在转移终点,这一群细胞的占比被大幅放大,说明它们在完成转移每一步时优势都略高于其他细胞。
第二套实验更加贴近真实病程。作者直接在小鼠体内用病毒感染支配乳腺区域的背根神经节,让这些神经元表达 MitoTRACER 构建,然后再将带有开关的癌细胞植入乳腺脂肪垫。在线粒体转移发生时,触发红转绿的过程完全发生在真实的神经–肿瘤界面中。和前一个模型相比,这种设计下原发灶中的绿细胞比例更低,大约只有 1–2%,但在肝和脑这样的远处器官中,绿细胞依然呈现明显富集,特别是在脑转移灶中,绿色细胞的比例显著高于原发病灶。
作者在黑色素瘤模型中也做了类似的追踪,虽然整体转移模式略有差异,但在脑组织中绿细胞的富集趋势依旧存在。这一系列结果共同指向一个结论:在原发肿瘤阶段接受过神经线粒体的癌细胞,在远处转移灶中出现的概率更高,尤其是脑转移。图 5 中描绘的“原发–肺–脑”的比例变化曲线非常适合放在这一部分,帮助读者将“起点仅占少数、终点高度富集”的趋势直观化。
07为什么脑转移对这种“神经供能”格外敏感?
在讨论部分,作者把焦点拉回到脑转移这个特殊场景。脑组织的代谢环境和其他器官有本质差异:神经元本身具有极高的能量需求,营养输入受到血脑屏障的限制,局部环境相对缺乏“把养分让给新来者”的余地。已有研究显示,能够在脑中稳定定植的癌细胞往往需要在代谢上完成一次针对性的重编程,以适应这种营养紧张、高需求的环境。
在这样的背景下,神经元线粒体的角色就变得耐人寻味。与多数上皮细胞相比,神经元线粒体在呼吸链配置和耦合效率方面更偏向高效输出,本身就是为高能源消耗场景优化过的“部件”。当这些线粒体被整合进癌细胞已有的代谢网络,相当于为一小群癌细胞预先配备了一套更适应脑环境的动力系统。再叠加前面提到的抗氧化和抗剪切能力,这些细胞在血流运输、通过微小血管时、以及进入脑内这种高压环境后,都更不容易被淘汰。从概率意义上讲,它们完成整个转移过程的成功率会更高,这就解释了为什么在终末转移灶,尤其是脑转移灶中,绿细胞的比例远高于原发病灶。
08这篇工作给“神经–肿瘤–代谢”这一条线加上了什么新拼图?
如果要用一句话概括这篇 Nature 的贡献,就是把“肿瘤依赖神经”的现象从宏观层面落实到一个可以精确追踪的细胞器转移事件上。神经对肿瘤的支持不再只是抽象的“信号增强”,而是包括实打实的线粒体转移,而且接受过线粒体的那一小群细胞在转移路径上具备明确优势。对基础研究来说,这提醒我们在讨论肿瘤代谢可塑性时,需要把非细胞自主的因素纳入框架,考虑邻近细胞通过器官elle乃至线粒体水平的支持为某些亚群提供怎样的竞争优势。对临床和转化研究而言,肿瘤神经密度、肿瘤细胞线粒体负荷以及线粒体转移相关结构,可能会成为评估转移风险甚至设计干预策略的新切入点。