CUSTOMER
客户中心
助力生命健康领域从基础研究到产业化的加速转化
在绝大多数烧伤愈合的讨论里,人们往往把注意力放在炎症强度、感染控制、血流供应以及基质再生这些宏观因素上,但这篇 2025 年的新研究把焦点放到一个常被忽略的层面——miRNA 的变化。作者在烧伤模型中系统筛查发现,miR-192-5p 在创缘组织中显著上调,而且它的变化幅度和创面修复速度之间存在非常紧密的关联。更关键的是,当 miR-192-5p 过量存在时,上皮细胞的增殖和迁移能力都被压了下去,让创面从一开始就处在一种“动力不足”的状态。
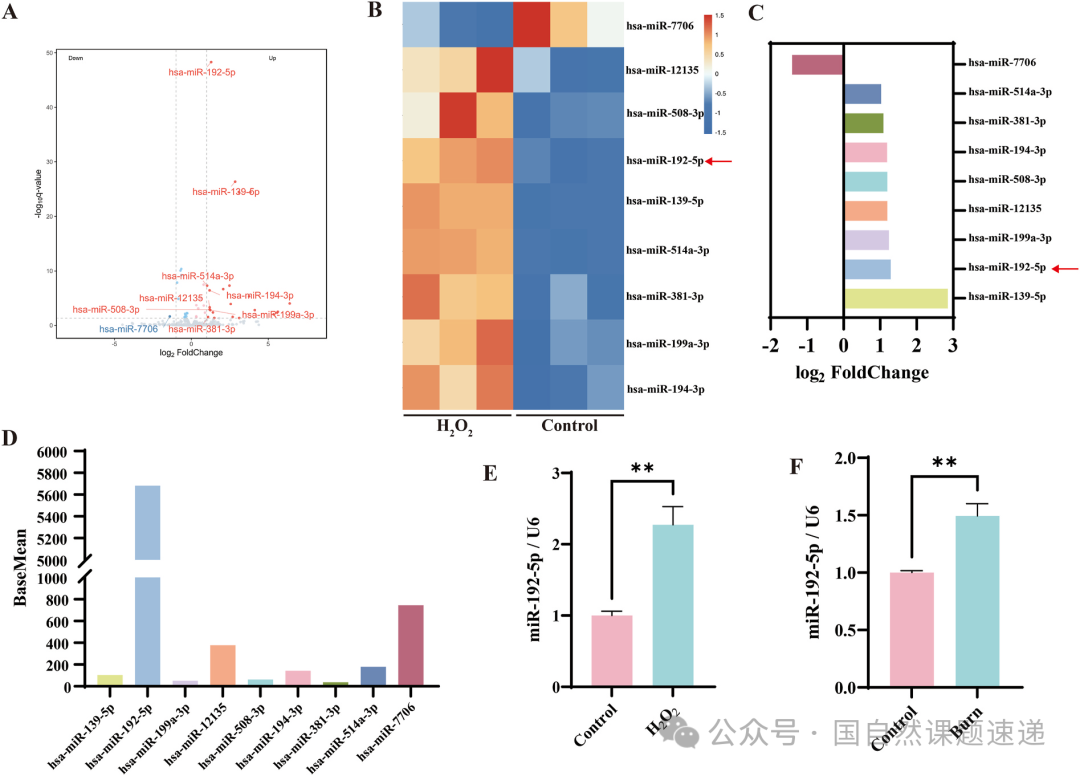
Fig. 1|功能性 miRNA 的筛选与鉴定
01
miR-192-5p 让创面一开始就“踩着刹车”
为了理解 miR-192-5p 到底在干扰什么,作者做了体内过表达和敲低实验。结果简单但直观:过表达会让全层皮肤缺损的愈合速度变慢,敲低则让创面闭合得更快。H&E 染色和表皮迁移分析进一步强调了这一点:miR-192-5p 的升高几乎等于给皮肤修复按下了刹车。
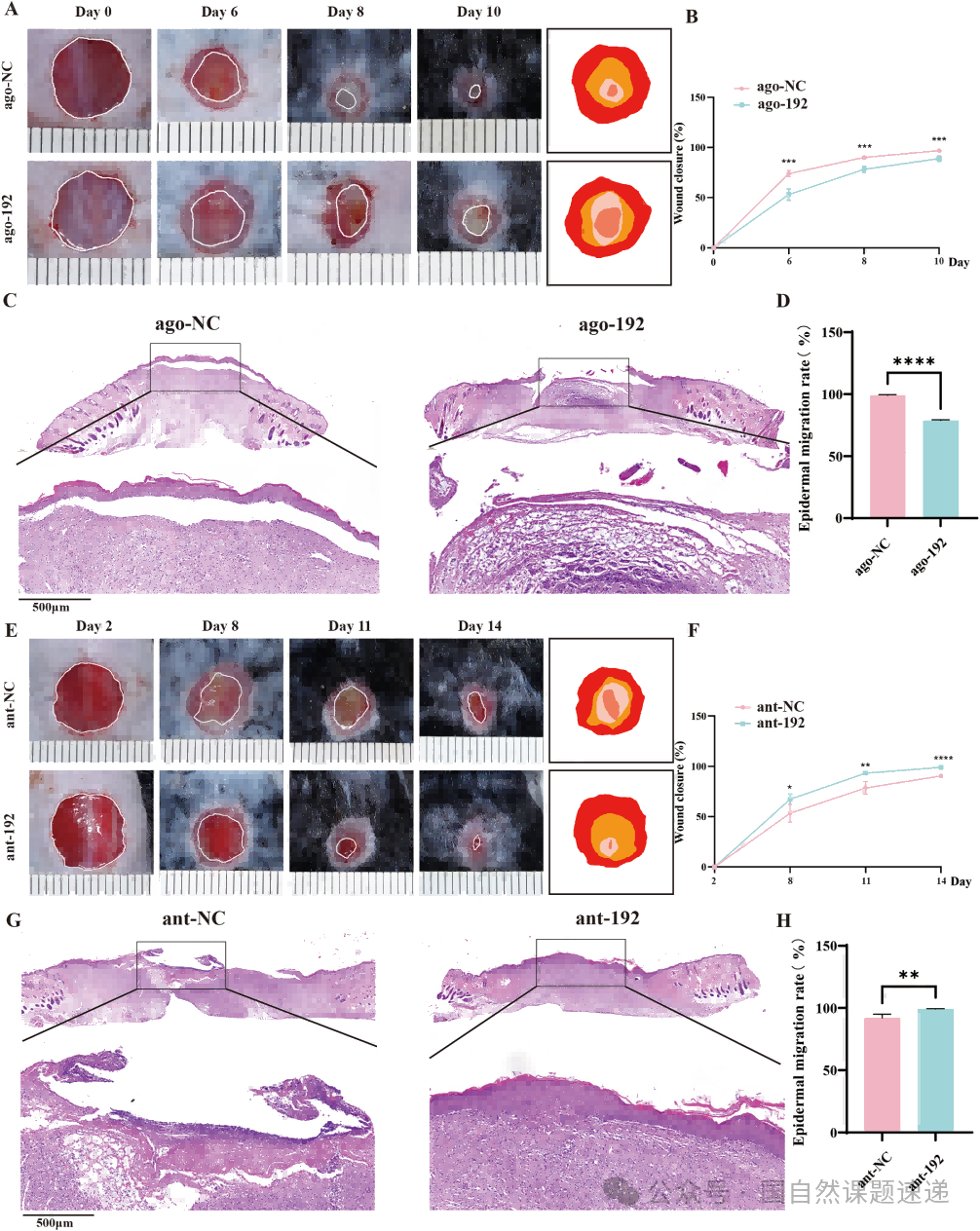
Fig. 2|miR-192-5p 对创面愈合的体内影响
顺着这条观察往下看,在细胞水平,miR-192-5p 的作用几乎是全方位的,会降低 HaCaT 细胞的活力,削弱迁移能力,增加凋亡,同时推高 ROS。换句话说,它让受损皮肤细胞从代谢到应激的各个环节都陷入了被动。相应地,当 miR-192-5p 被抑制后,这些变化又能逆转回来。
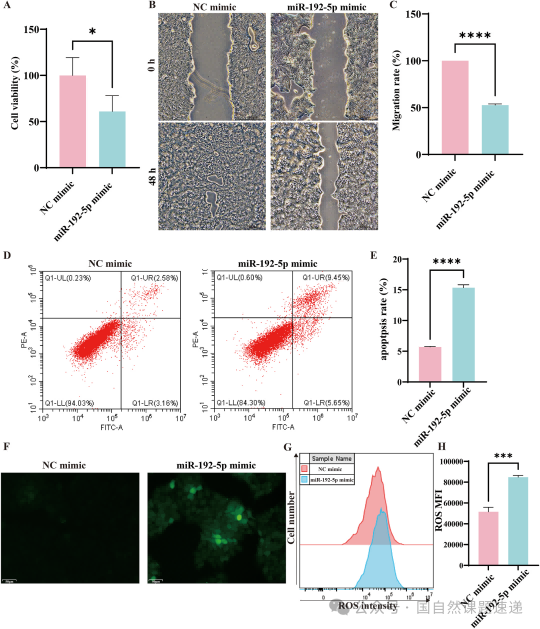
Fig. 3|miR-192-5p 抑制 HaCaTs 增殖与迁移,并促进凋亡及氧化应激
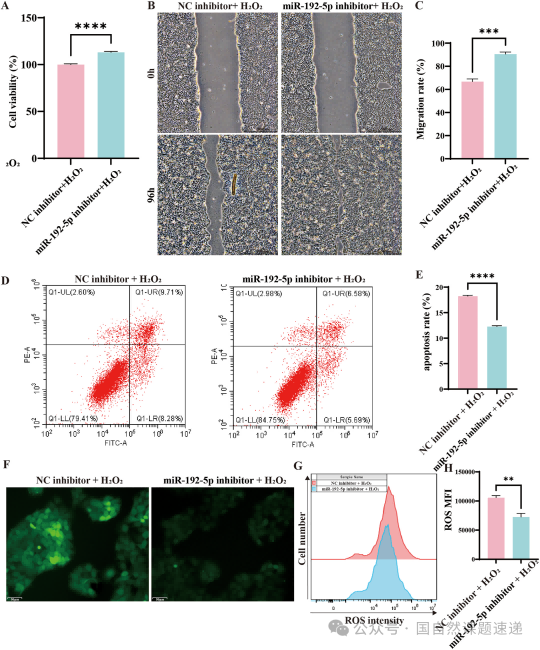
Fig. 4|氧化应激条件下 miR-192-5p 敲低对 HaCaTs 的影响
02
OLFM4:被 miR-192-5p 推倒的那块关键多米诺骨牌
miR-192-5p 并不是单独行动,它抑制的是一个叫 OLFM4 的下游靶基因。作者从差异基因分析做起,结合靶点预测数据库,把候选范围一步步缩窄,最终锁定 OLFM4。通过野生型和突变型 3′UTR 的荧光素酶实验,他们证明 miR-192-5p 可以直接结合 OLFM4 相关位点,从而压制其表达。进一步的 RT-qPCR、Western blot 和免疫荧光结果显示,在氧化应激和 miR-192-5p 过表达的条件下,OLFM4 的 mRNA 与蛋白水平均明显下调,而敲低 miR-192-5p 则能把这部分表达拉回来。
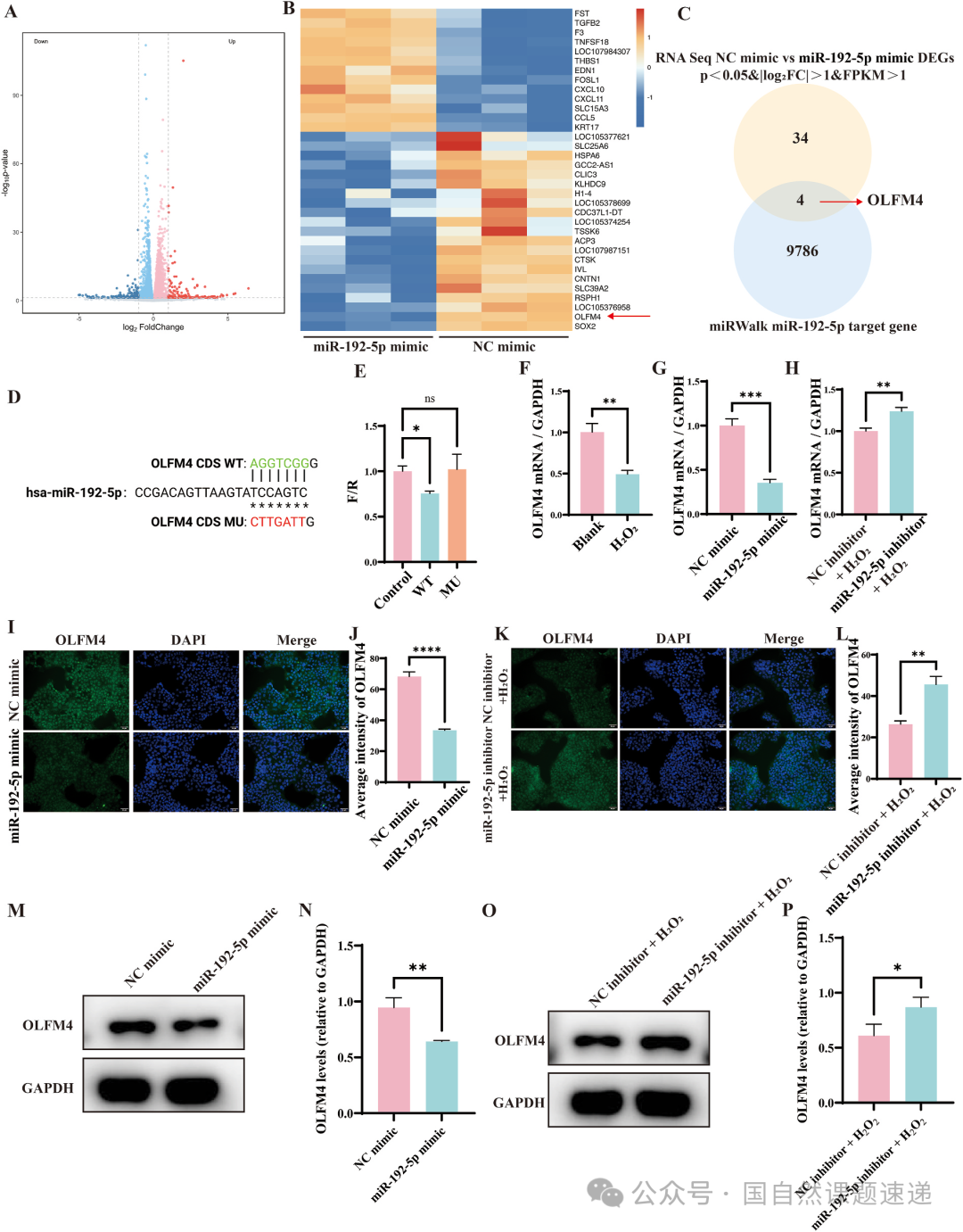
Fig. 5|miR-192-5p 下游靶基因的筛选与验证(OLFM4)
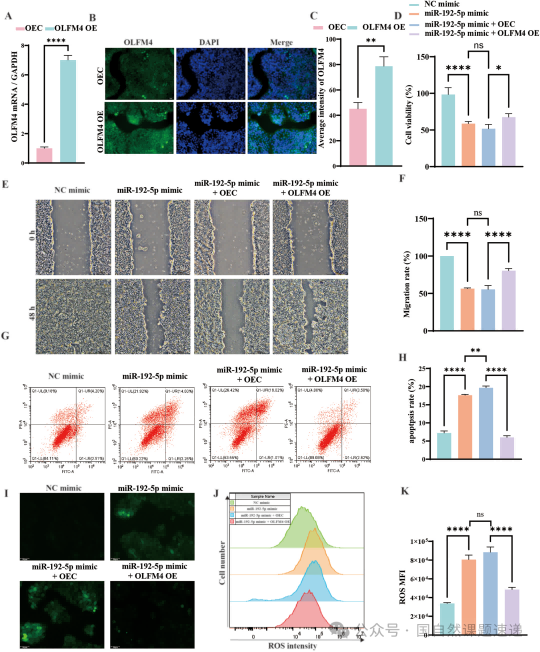
Fig. 6|OLFM4 过表达可抵消 miR-192-5p 过表达造成的损伤
更有说服力的是反向实验:当 miR-192-5p 被敲低后,细胞本应恢复,但如果此时再敲掉 OLFM4,恢复效果会被明显抵消。也就是说,救回来的是 OLFM4,不是别的“顺带受影响”的基因。这样的“救援—反救援”设计,把整个链路从相关性提升到了因果性:烧伤后上皮修复变慢,并不是简单的炎症或坏死,而是 miR-192-5p—OLFM4 轴在分子层面持续踩着刹车。
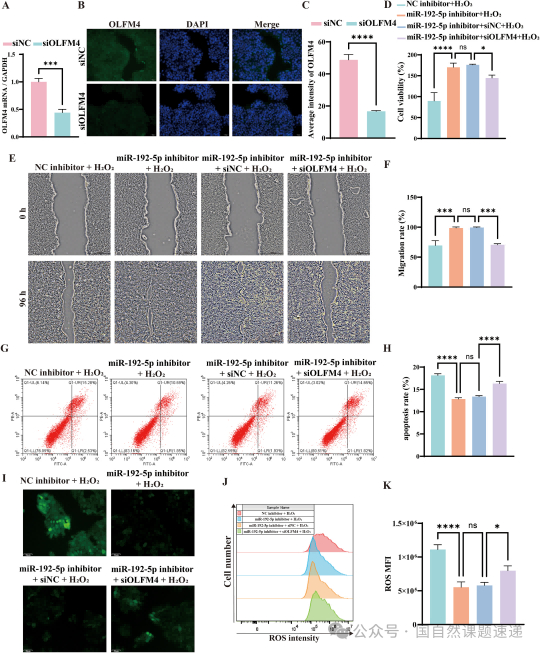
Fig. 7|敲低 OLFM4 可反转 miR-192-5p 敲低的保护作用
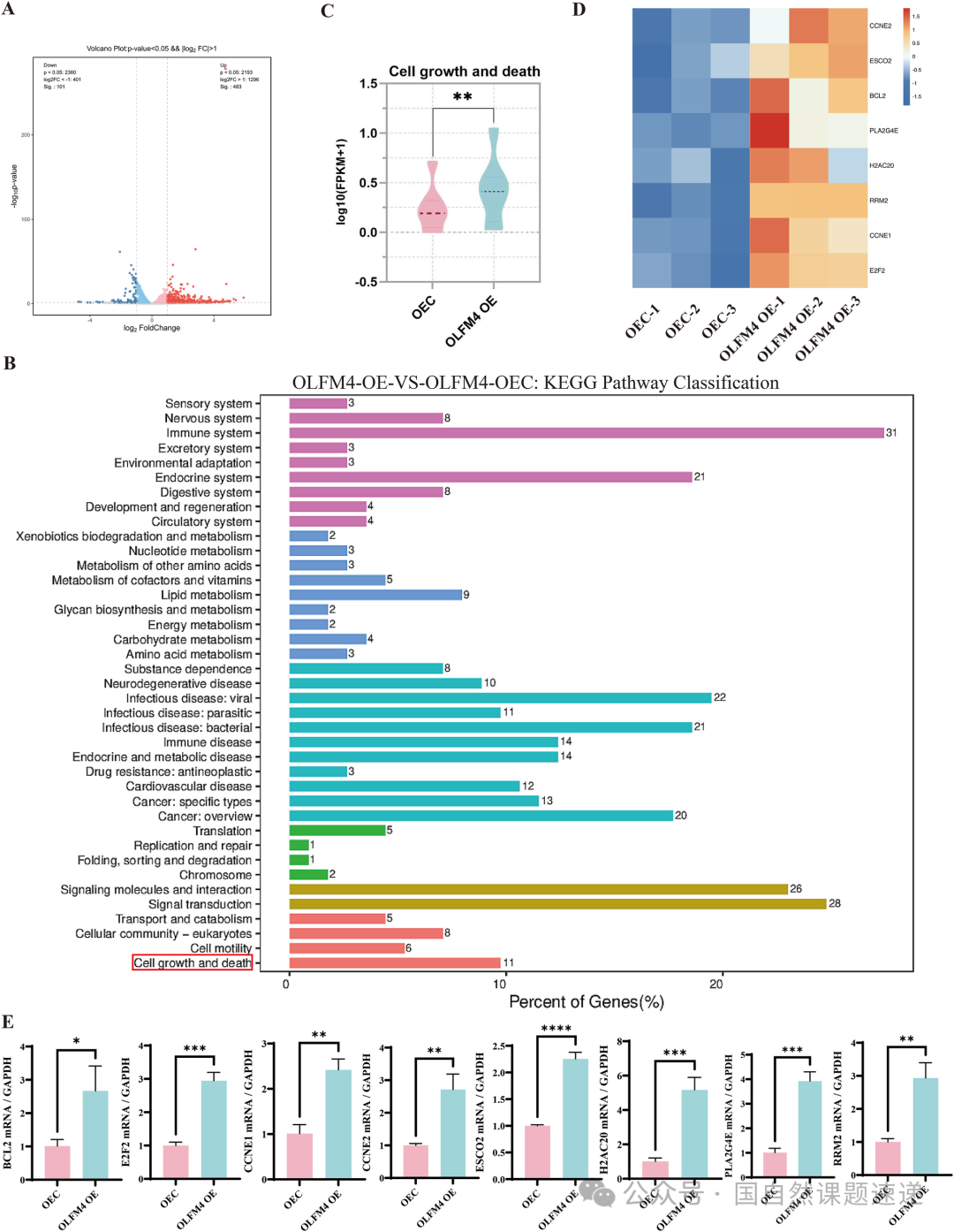
Fig. 8|OLFM4 对 HaCaTs 增殖与凋亡影响的机制探索
03
miRNA在创面里活不过多久
miR-192-5p 过高会压制 OLFM4,导致上皮细胞增殖减弱、凋亡增加、ROS 积累;反过来,使用 miR-192-5p 抑制剂(anti-192)能重新启动修复程序。从原理上看,anti-192 是一个合理的治疗工具。然而一旦把视角拉回到真实创面环境,难题马上出现:裸 miRNA 在烧伤创面里几乎活不过几个小时。高浓度核酸酶会快速降解它,剧烈的氧化压力会进一步损伤,组织液渗出和炎症细胞吞噬则不断清空局部有效分子。医学上常说“药物需要足够的暴露时间”,在这种环境下,单纯的局部注射很难做到这一点,效果再好也撑不过微环境的消耗。
04
工程外泌体:先给 anti-192 找一辆“防弹车”
为了解决这一层障碍,作者选择用 MSC 来源的外泌体来承载 anti-192。外泌体本身就是细胞之间交流信息的天然载体,结构稳定,又容易被靶细胞摄取,非常适合用来运送核酸类分子。研究中构建的工程外泌体 Exo-ant-192,在形态、粒径、外泌体标志物等方面都通过了标准表征,同时证实 HaCaT 细胞可以高效摄取这些外泌体,细胞内 miR-192-5p 水平因此明显下降,细胞活性、迁移能力和抗凋亡能力得到恢复。
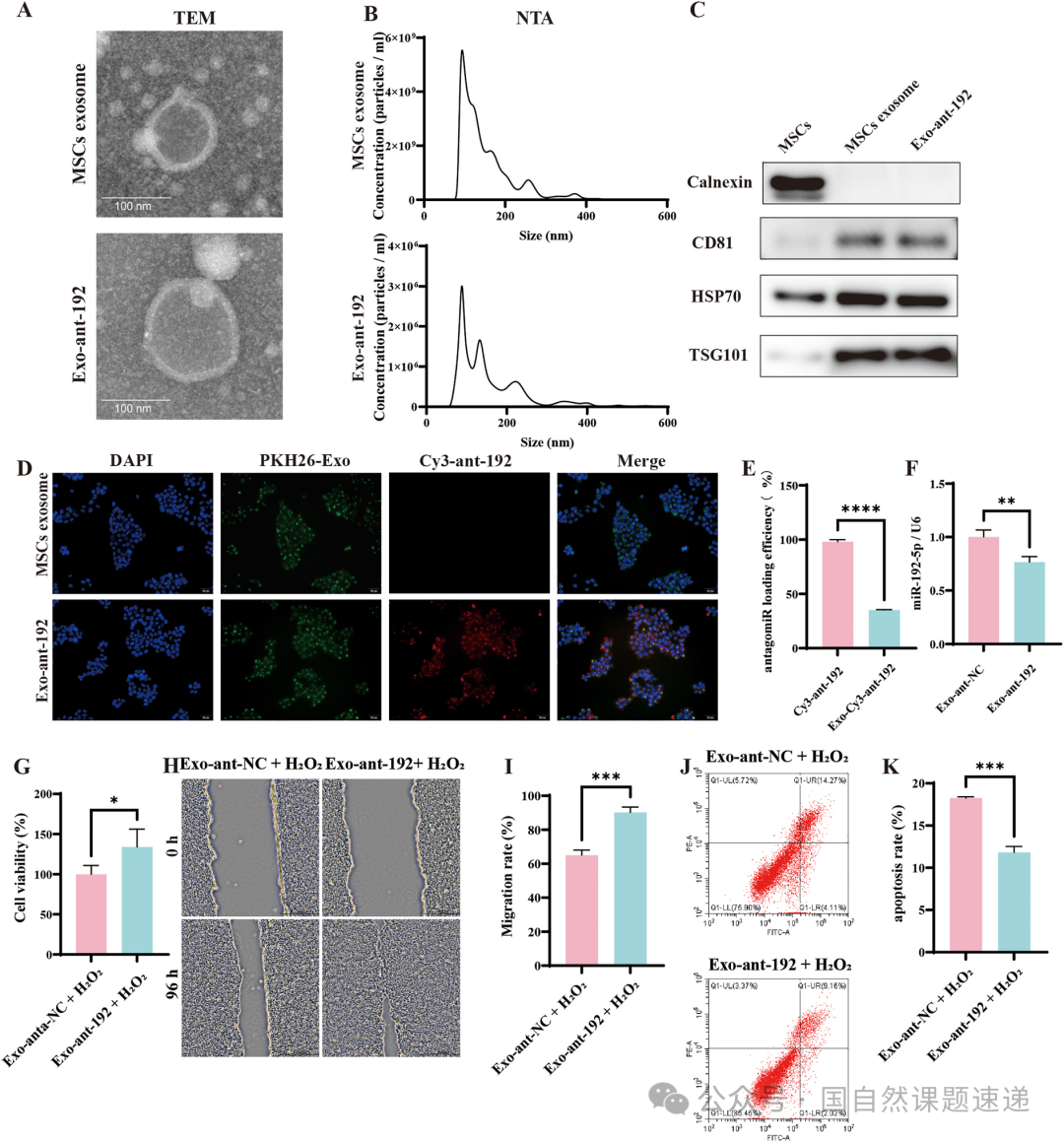
Fig. 9|miR-192-5p 工程化外泌体(Exo-ant-192)的制备与表征
不过,外泌体虽然能保护 anti-192 不被立刻降解,却仍然躲不过烧伤创面本身的严苛条件:炎症环境会加速其清除,局部渗出会把外泌体带离创面,导致有效浓度难以持续保持。要真正解决“足够长时间地待在伤口上”这个问题,还得再给外泌体加一层保护。
05
MXene-GelMA 水凝胶:再为外泌体搭一个长期停靠的“仓库”
作者选用 GelMA 作为水凝胶基础骨架,再引入具有抗氧化和免疫调节能力的 MXene 构成 M-Gel。这样的组合一方面保持了良好的生物相容性,另一方面增加了材料本身对 ROS 的清除能力和对炎症环境的耐受性。更疏松而均匀的孔隙结构,加上增强的力学性能,使得 M-Gel 在创面上既不易被冲走,也能为外泌体提供一个相对稳定的“仓库”,让它们缓慢释放。材料层面,作者用 SEM、吸胀曲线、降解曲线、外泌体释放曲线和应力–应变测试做了系统验证,并且观察了与 RAW264.7 共培养后,NO 合成酶和炎症因子的变化,证明 M-Gel 本身就具有一定的抗炎趋势。

Fig. 10|Exo@M-Gel 水凝胶的制备与表征
当 anti-192、工程外泌体和 MXene-GelMA 水凝胶三者组合在一起,就形成了 Exo-ant-192@M-Gel 这套最终的治疗体系。它的设计逻辑其实很简单:miRNA 解决的是“分子靶点”,外泌体解决的是“细胞内递送”,水凝胶解决的是“创面暴露时间和微环境”。三层叠加之后,才有资格在高炎症、高 ROS 的烧伤环境里谈“持续发挥作用”。
06
Exo-ant-192@M-Gel 在动物模型里到底表现怎样?
在体内实验中,作者把不同处理方式覆盖在烧伤创面上进行直接对比。结果显示,Exo-ant-192@M-Gel 组不仅在早期就能明显缩小创面面积,还在整个观察周期内保持着最高的愈合率。H&E 染色显示其肉芽组织更成熟、上皮重建更完整,Ki67 标记提示局部细胞增殖更活跃,而 CK14 免疫荧光则说明新的上皮层结构更接近正常皮肤。更重要的是,通过带有荧光标记的 miRNA 成像可以看到,Exo-ant-192@M-Gel 能在创面区域保持更长时间的信号,说明有效成分并没有很快流失。
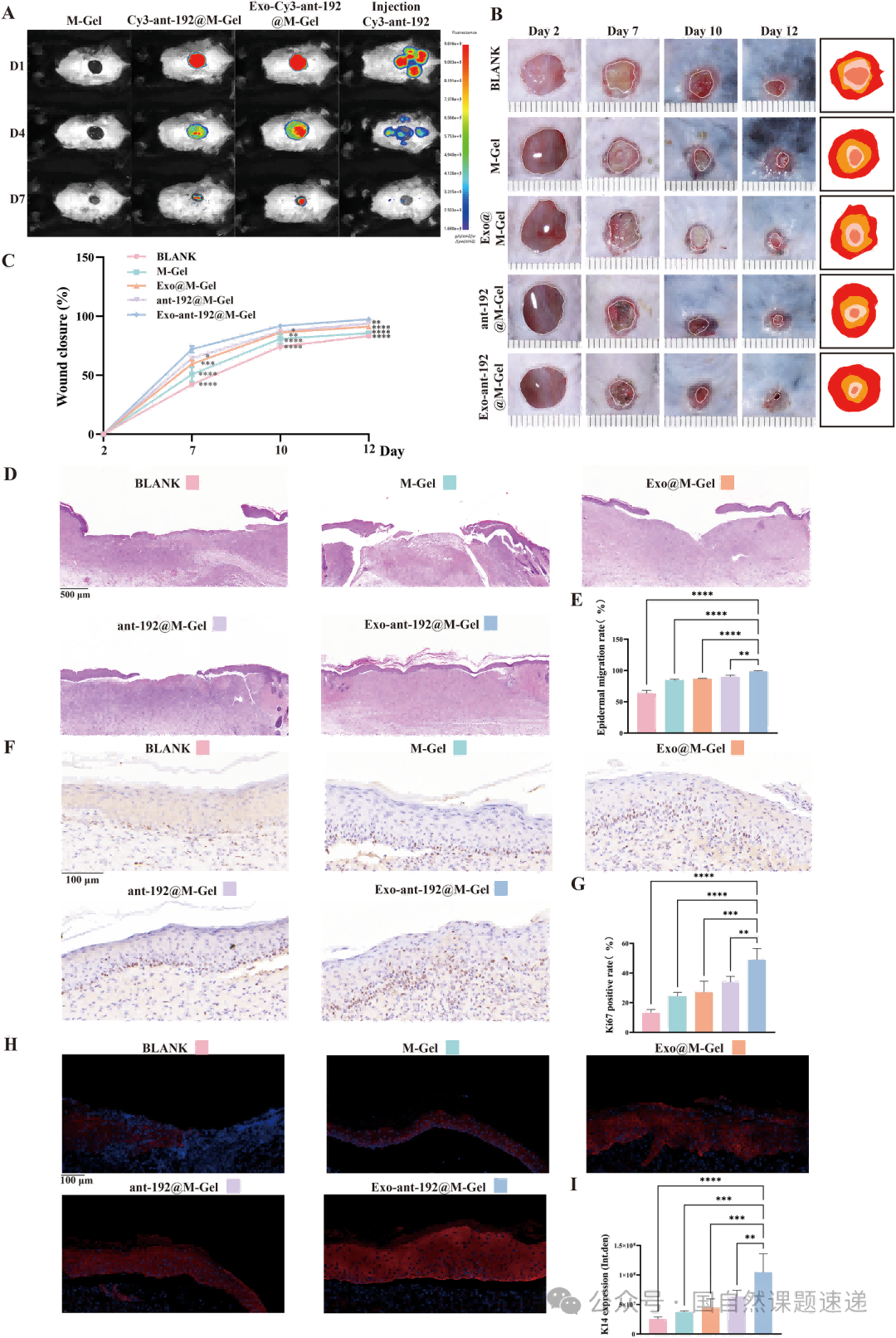
Fig. 11|Exo-ant-192@M-Gel 持续释放 ant-192 并加速烧伤创面愈合
研究的最后,作者用一幅示意图把整个治疗链条整理出来:从烧伤后 miR-192-5p 上升、OLFM4 被抑制、上皮修复受阻的病理状态,一直到使用 Exo-ant-192@M-Gel 将这条轴线“逆转”,恢复细胞活性、减轻炎症、加速创面闭合的过程。
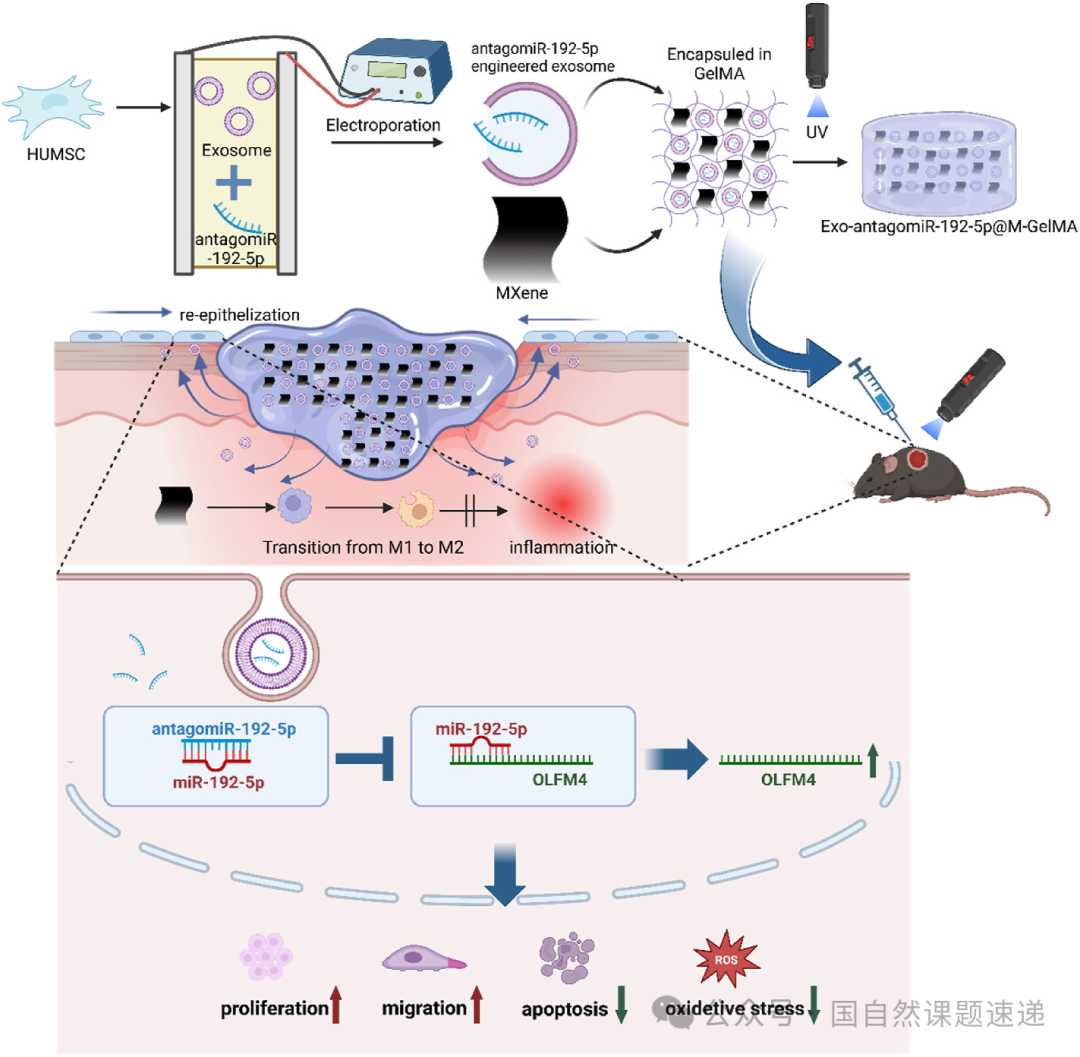
Fig. 12|Exo-ant-192@M-Gel 加速烧伤创面愈合的示意图
07
这套方案真正有价值的地方在哪里?
这篇工作其实是在系统性清理一条治疗路径上的所有堵点。首先是分子层面,找到一个在烧伤中被异常激活、又直接压制修复能力的 miRNA,并把其下游关键靶点 OLFM4 机制说清楚;其次是递送层面,用工程外泌体解决 miRNA 在细胞内定向递送与保护的问题;再往外一层,是微环境和暴露时间的问题,用 MXene-GelMA 水凝胶抵抗创面高炎症、高 ROS 的破坏,同时提供一个长期释放的仓库。最终合成的 Exo-ant-192@M-Gel,不仅是一种特定组合,更是一条可复用的设计思路:面对复杂创伤环境时,想让一个分子真正发挥作用,就必须逐层拆解——如何选择靶点、如何送进细胞、如何在不友好的环境里活得足够久。
从这个角度看,这篇工作给出的不只是一个“烧伤愈合材料”,而是一套可迁移的框架,可以被套用到其他核酸药物、糖尿病足溃疡、放射性皮肤损伤甚至某些慢性炎症性疾病的局部治疗中。对做基础研究的人来说,它提醒我们在讲“分子机制”的同时,要想一想这些分子在真实组织环境里能否被稳定利用;对做转化和临床的人来说,它展示了一个从分子到材料、从细胞到动物的完整递送闭环,这一点,往往比单纯堆砌更多“新材料、新分子”更有参考价值。