CUSTOMER
客户中心
助力生命健康领域从基础研究到产业化的加速转化
胰腺导管腺癌(PDAC)的一个核心难点是肿瘤细胞状态高度异质:同一肿瘤里常同时存在上皮样细胞与间充质样细胞,并伴随EMT相关转录程序。临床研究里经常能看到“某分子升高→进展更快/预后更差”的结论,但这类结论很容易卡在两点:这个分子究竟来自哪类细胞;它到底只是伴随出现的标记物,还是能真实驱动细胞状态转换的关键环节。该研究的价值在于把问题从“相关性描述”推进到“细胞通讯机制的因果链条”,并进一步验证了可干预的入口。
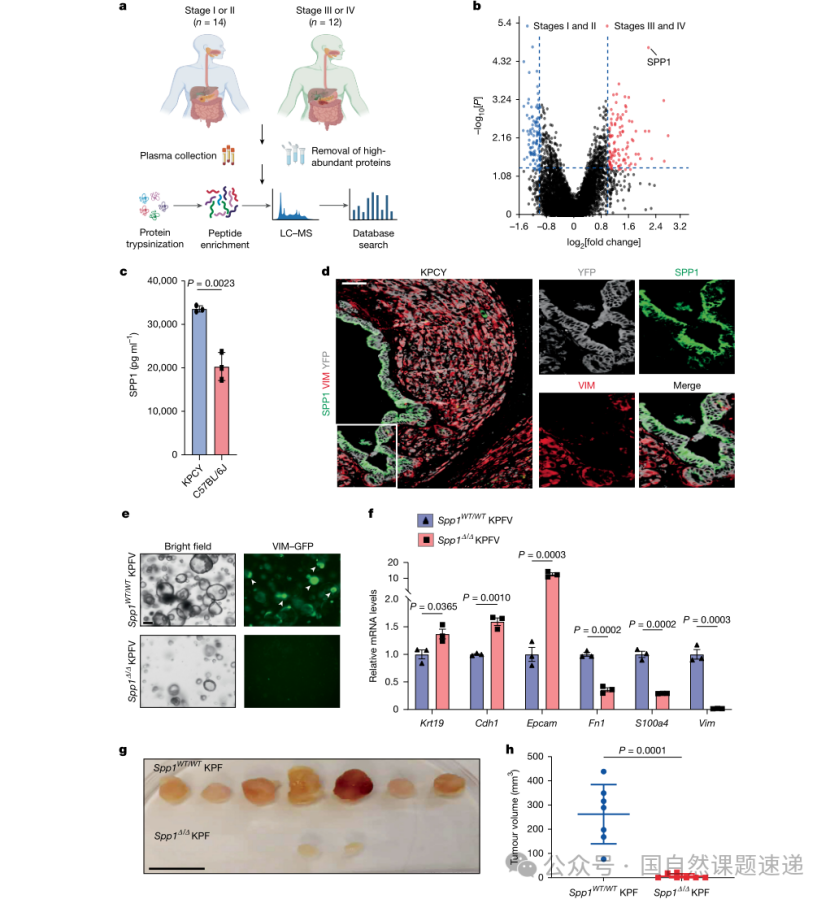
图1 | EPCs分泌 SPP1维持 MPC 身份
01
血浆蛋白组把候选因子锁定在可溶性信号
研究并未直接从肿瘤组织里大范围筛基因,而是先从临床血浆蛋白组切入,对早期(I/II期)与晚期(III/IV期)PDAC患者血浆蛋白水平进行比较,发现晚期样本中SPP1显著升高,并在KPCY小鼠模型血浆中观察到一致趋势。这样的切入点很“克制”:血浆层面的差异优先提示“可溶性因子参与系统性进展”,天然更贴近细胞间通讯与临床可转化路径,而不是只在组织切片里解释局部现象。
在方法上,血浆样本首先离心去除细胞碎屑,随后进行去高丰度蛋白处理以降低动态范围,再依次完成还原、烷基化、胰蛋白酶消化与C18脱盐,最后进入质谱检测。质谱平台采用高分辨率仪器并以DIA方式采集,数据库检索采用DIA-NN并严格控制FDR。对蛋白组数据中不可避免的缺失值,研究使用K近邻插补(KNNImputer)完成数据补全,保证统计分析的可用性与一致性。
这一整套设计的意义在于,它把候选分子筛选从一开始就放在“可扩散信号—细胞互作—疾病进展”这条逻辑线上,为后续机制验证提前定好方向。
02
单细胞与大队列把SPP1放进EMT与细胞状态框架
发现SPP1升高之后,研究没有停留在“SPP1是坏指标”这一层,而是进一步利用公共单细胞转录组数据,把肿瘤细胞按SPP1表达水平分层比较。结果显示,SPP1高表达的癌细胞群更显著富集EMT相关基因集合。进一步在大规模转录组队列中,SPP1高表达同样与EMT基因集富集以及更差预后相关联。
这一步的作用不是“把结论堆得更大”,而是为下一步因果实验提出可检验命题:SPP1可能并非单纯反映肿瘤负荷,而是与细胞状态转换、尤其是间充质样细胞群的维持有关。真正的关键在于,这个命题是否能被模型系统证明其必要性与充分性。
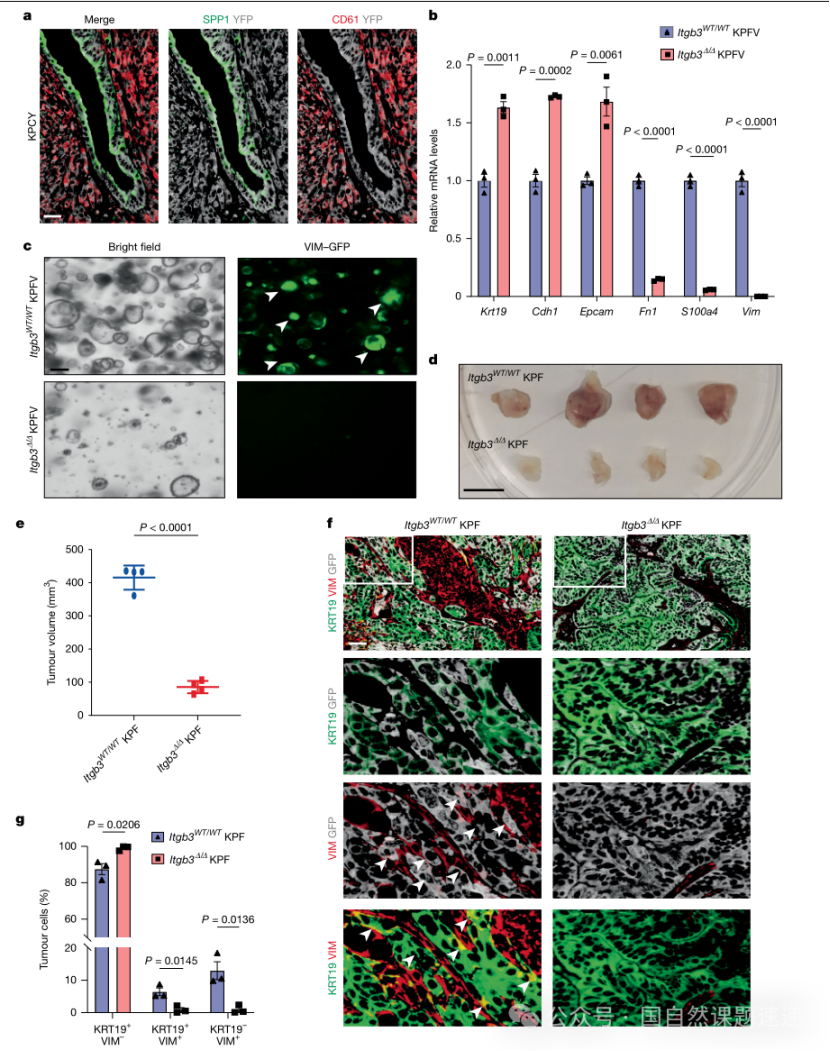
图2 | CD61对 MPC身份的维持至关重要
03
关键模型:VIM-GFP类器官
为了把“细胞状态”从抽象概念变成可追踪指标,研究建立了来源于KPFV小鼠肿瘤的类器官模型,并引入Vim-GFP报告系统,使得间充质样细胞状态可以通过GFP信号直接识别。这样一来,研究者不必只依赖终点的免疫染色去“回看”状态,而可以在培养、处理与基因操作过程中实时追踪细胞亚群比例变化。
类器官建立过程也体现了严格的可复现性:肿瘤组织被剪碎至较小尺寸后,使用包含胶原酶、Dispase与DNase的消化体系在控制温度与转速下充分消化,再结合TrypLE进行进一步解离,过滤与红细胞裂解后将细胞嵌入Matrigel并使用含多种生长因子、通路抑制剂与条件培养基的体系维持生长。对类器官而言,培养体系不是“通用配方”,而是决定能否保留肿瘤异质性与细胞互作关系的核心条件之一。
这一模型的关键价值在于:它既保留了肿瘤细胞状态的分化与互转空间,又允许在可控环境中进行基因编辑、配体-受体验证以及药理干预,从而建立因果链条。
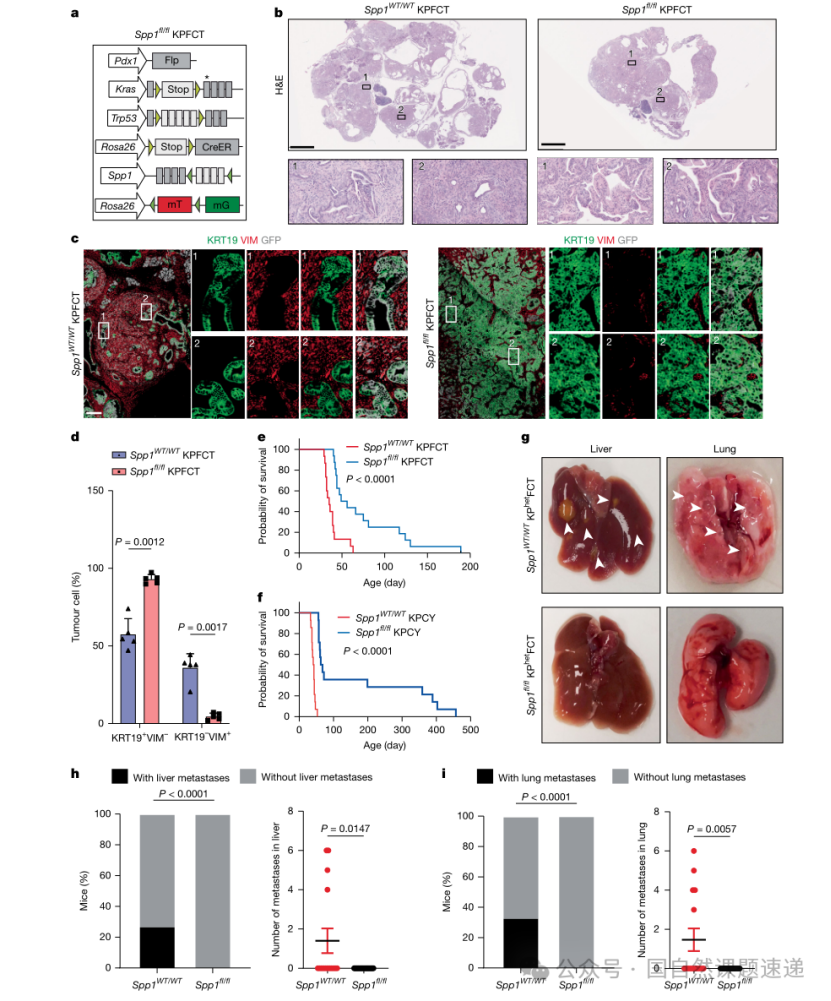
图3 | Spp1失活抑制 PDAC发展和转移形成
04
敲除SPP1直接打断MPC维持
研究在该类器官系统中采用CRISPR–Cas9敲除Spp1。结果显示,SPP1在肿瘤中主要由上皮样PDAC细胞表达,而不是由VIM阳性的间充质样细胞群产生。更重要的是,当Spp1被敲除后,VIM-GFP阳性的间充质样细胞群显著减少,同时移植实验中的成瘤能力下降,肿瘤组织更偏上皮样特征。
这一步回答的是“必要性”:如果切断SPP1会导致间充质样细胞群无法维持,那么SPP1很可能位于上皮—间充质互作的上游,而非简单的伴随指标。
05
受体层面锁定CD61(Itgb3):配体与受体双端互证
可溶性因子能否真正驱动细胞状态,最终要落在受体端。研究将注意力集中在SPP1已知受体之一的整合素CD61(Itgb3),并通过组织层面证据显示SPP1与CD61在肿瘤中呈互补分布,且CD61主要在间充质样细胞群中表达。
随后研究在类器官中CRISPR敲除Itgb3,得到非常一致的表型:Itgb3缺失后几乎看不到VIM-GFP阳性细胞,间充质标志物表达下降,移植成瘤能力显著降低,整体效应与Spp1敲除高度相似。
这一设计的价值在于,它避免了只靠“通路富集”或“受体共表达”来推断作用机制,而是用遗传学方式在配体端与受体端形成闭环:敲掉配体与敲掉受体得到一致结果,显著增强了“SPP1通过CD61在MPC端发挥作用”的可信度。
06
条件敲除结合超声三维定量
体外类器官与皮下移植可以支撑因果判断,但PDAC的真实生态位仍在胰腺及其复杂微环境中。研究构建了带CreER系统的Spp1条件敲除模型,并在指定月龄给予他莫昔芬诱导敲除,使研究者能够在肿瘤发生发展的过程中“按时间切断”SPP1信号,而不是只在终点做比较。
体内肿瘤负荷的评估采用小动物超声成像:先以二维模式定位肿瘤,再以固定步进获取连续切面并进行三维重建,最终计算肿瘤体积。相较只做终点取材的设计,这种方式能提供更连续、更可量化的生长轨迹,从而让“SPP1缺失导致肿瘤进展受抑”这一结论更扎实。
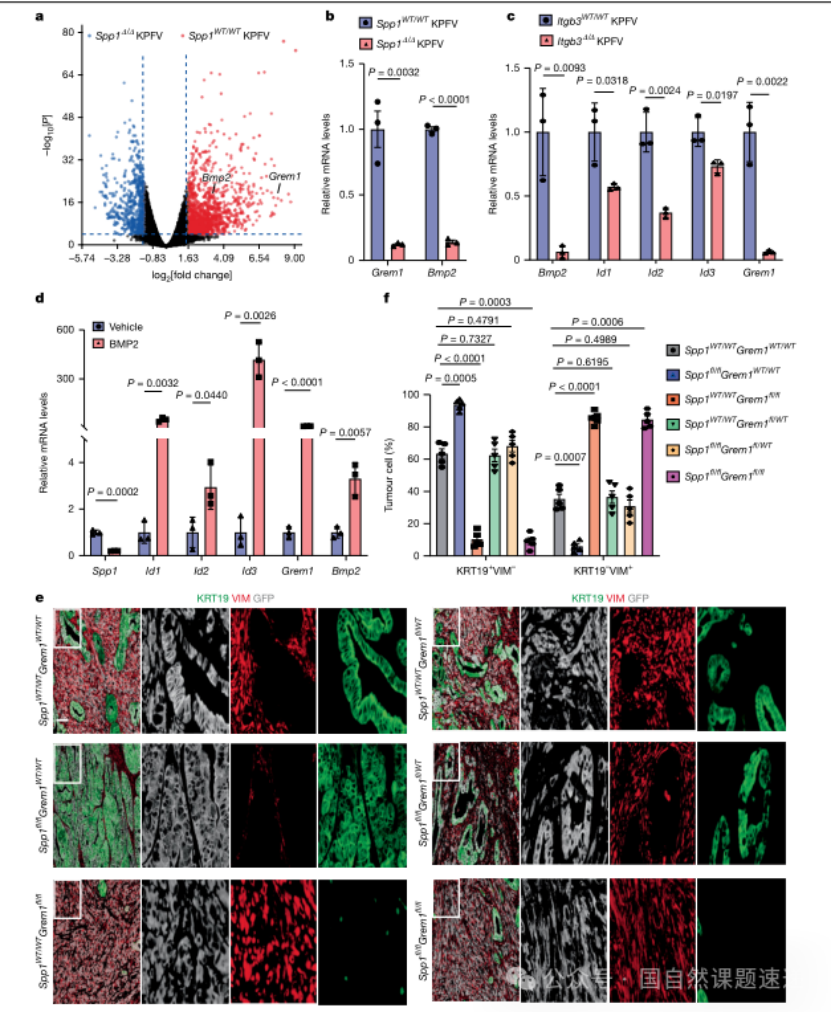
图4 | SPP1 通过 CD61诱导 BMP2维持 MPC 命运
07
差异表达→通路干预→ChIP定位转录调控
在确认SPP1-CD61轴对MPC维持是必要的之后,研究进一步追问下游的分子机制。研究采用转录组差异分析筛选关键变化基因,并结合通路层面证据与药理学干预,提出SPP1通过CD61激活NF-κB通路,进而诱导Bmp2表达,并牵引BMP信号轴相关基因变化。
为避免“通路富集=机制成立”的常见漏洞,研究进一步在转录调控层面给出证据:先利用转录因子结合位点数据库对Bmp2启动子区域进行预测,锁定RelA可能的结合位点,再通过染色质免疫沉淀(ChIP)与qPCR验证RelA在Bmp2启动子上的富集。这样一来,“NF-κB参与”不再只是推断,而是被钉在可验证的DNA-蛋白相互作用层面。
同时,研究也通过BMP通路刺激与抑制实验展示反馈关系:BMP2处理可诱导典型BMP靶基因并推动Grem1上调,而BMP抑制剂会呈相反效应,并伴随Spp1表达在时间维度上的变化,提示该网络存在动态调控与互相制衡。
08
遗传互作验证
研究最终提出,上皮样与间充质样细胞亚群通过SPP1、BMP2与GREM1等可扩散因子形成互作网络,彼此维持对方的存在。为了证明这不是“把几个分子串在一起的解释”,研究进一步通过遗传学组合实验检验网络内部的功能对抗与依赖关系:在特定基因组合敲除背景下,关键表型能够被部分逆转或回拉,提示这些因子在决定细胞命运方面存在明确的功能互作。
这种遗传互作验证非常重要,因为它把多个分子放进同一个因果框架中比较,避免出现“每个分子都做过实验,但彼此关系只能靠语言连接”的不严谨问题。
09
中和抗体与人源PDO模型
当机制链条足够清晰后,研究自然转向可干预性。研究在小鼠模型中开展SPP1中和抗体治疗,并设置同剂量同频率对照IgG以控制非特异效应。同时,在人源体系上,研究构建患者来源类器官(PDO)的异种移植模型,包括皮下移植与超声引导胰腺原位移植,分别用于验证生长抑制效应与更贴近器官生态位的反应。
PDO体系的价值在于,它比传统细胞系更能保留患者肿瘤的遗传背景与表型特征,使“SPP1轴干预是否具备跨物种、跨模型的一致性”得到更可靠的检验。
总结
这项工作最值得参考的不是某一个技术点,而是它的整体研究组织方式:先用临床血浆蛋白组把候选因子锁定在可溶性信号层面,再用单细胞与大队列把候选放进细胞状态与EMT框架,随后用带报告系统的类器官实现可追踪读出,用CRISPR在配体与受体两端互证形成因果闭环,再把结果推进到体内条件敲除与超声三维定量的过程追踪,机制拆解上通过转录组差异、药理干预与ChIP把通路落实到转录调控证据,最后用抗体中和与人源PDO移植验证可干预性与转化潜力。
对希望做“机制+转化”路线的研究者而言,这是一种更稳、更可复现的范式:每一步都围绕上一层结论提出更强的可检验命题,并用能最大化因果强度的模型与读出把证据做实。
扩展数据图片
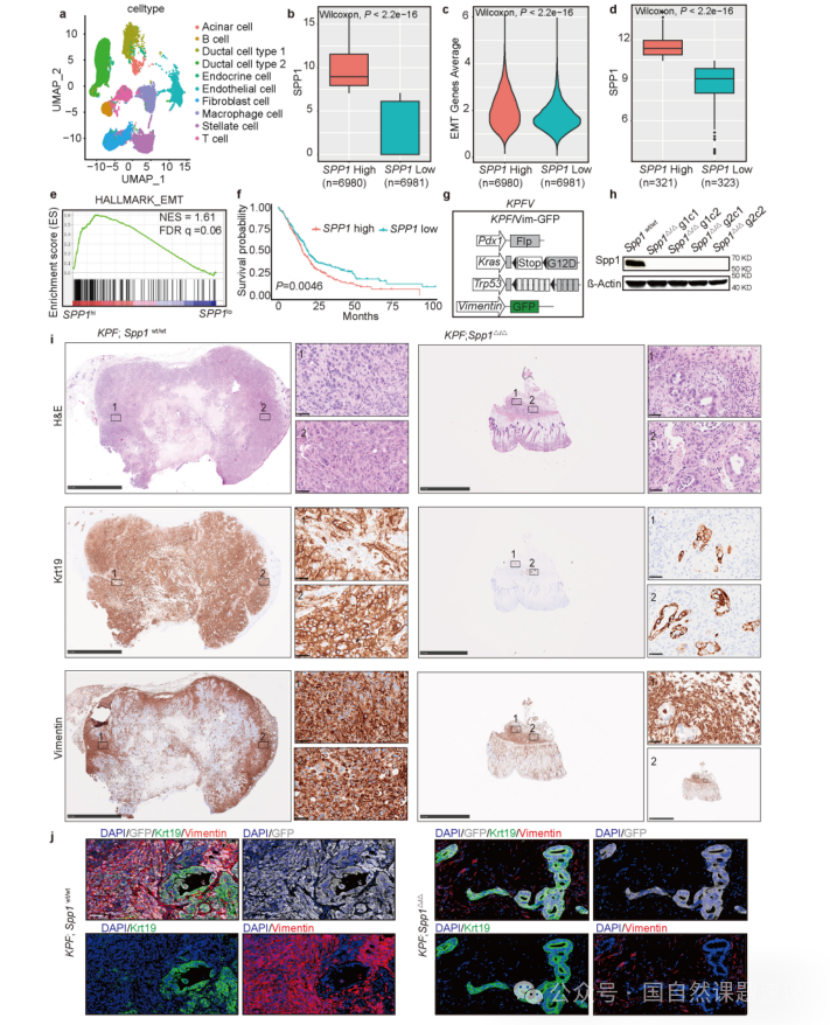
Extended Data 图1| SPP1在人类和小鼠PDAC中的作用
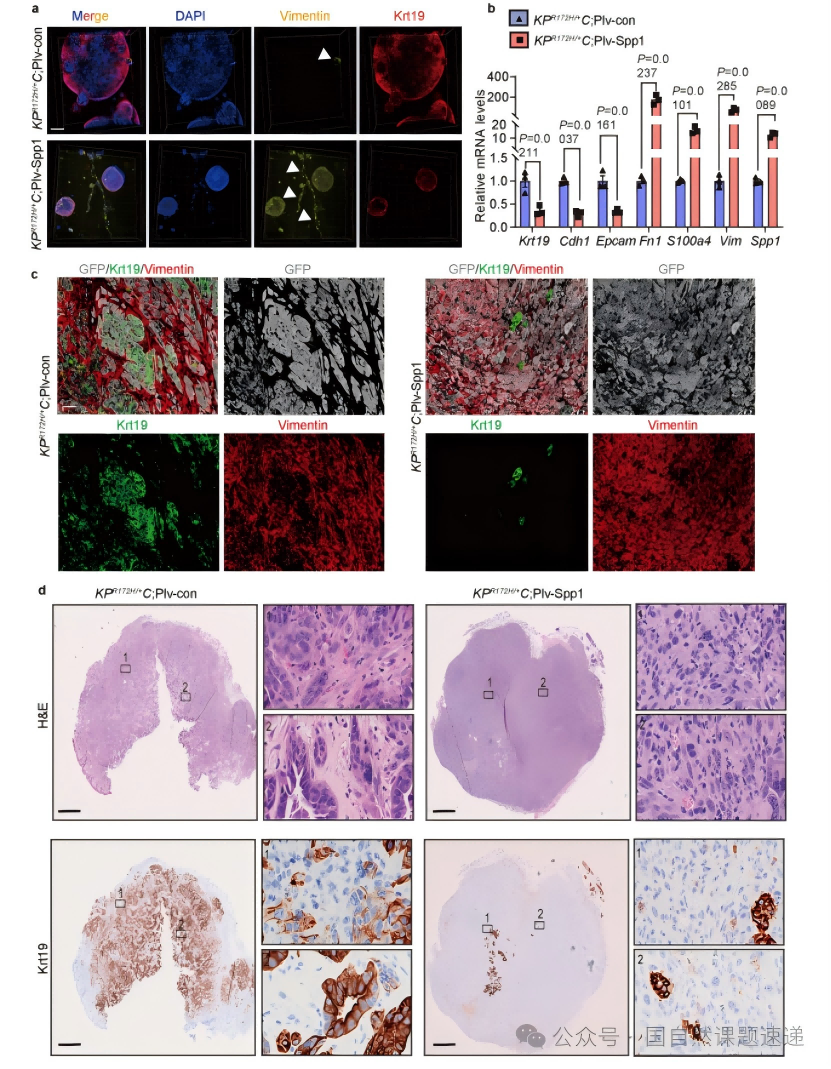
Extended Data 图2 | SPP1过表达诱导PDAC的间充质转变
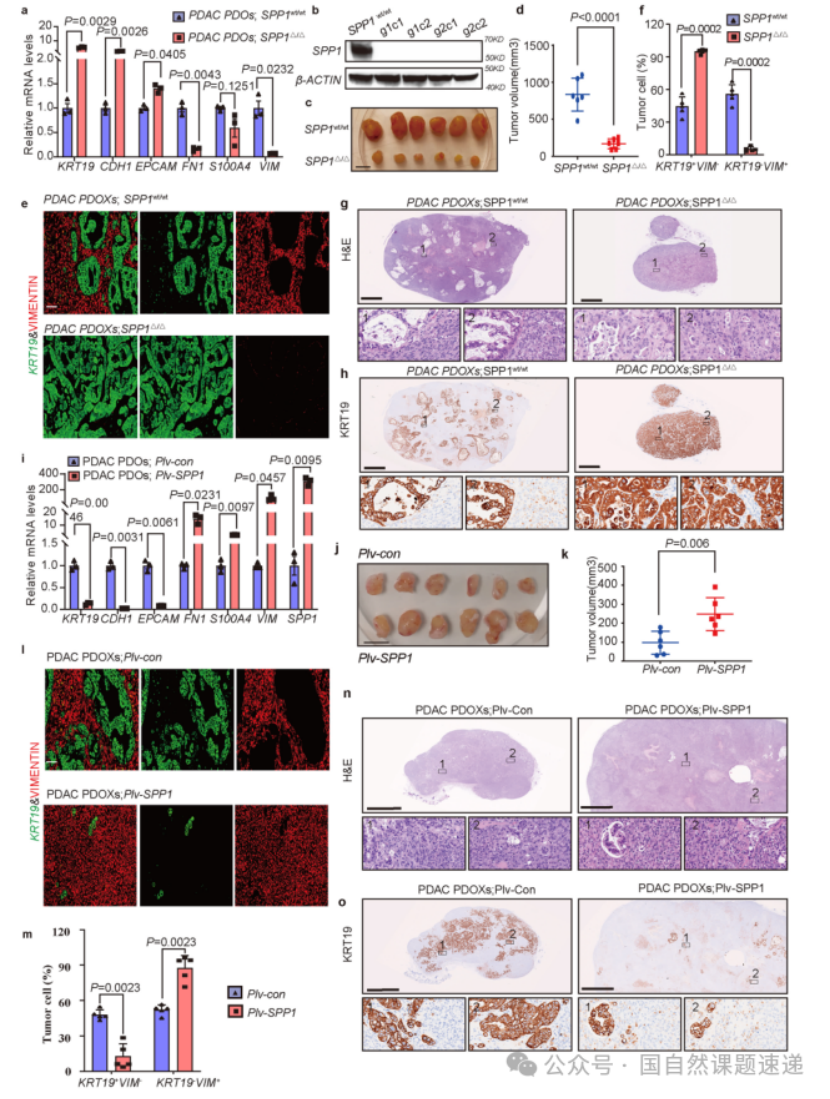
Extended Data 图3 | SPP1在人类PDAC发展中的作用
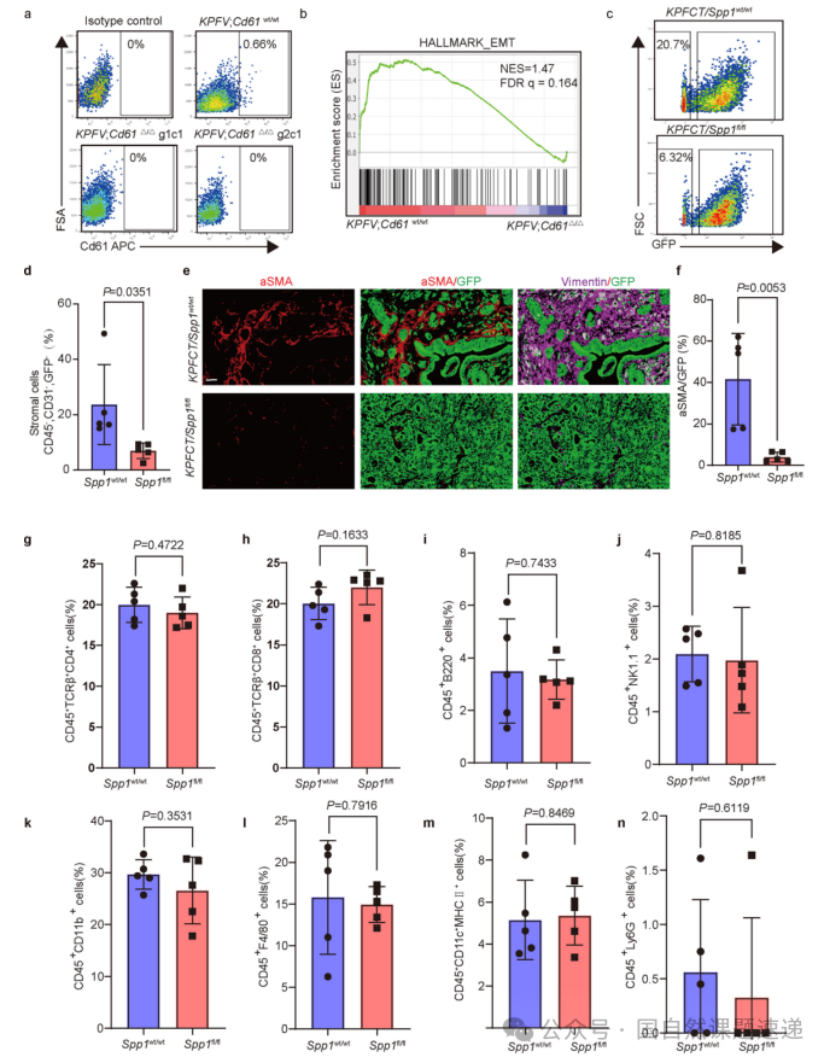
Extended Data 图4 | Spp1通过 Cd61 维持 MPC 身份及其在 Spp1 删除后肿瘤基质组成和免疫细胞浸润中的影响
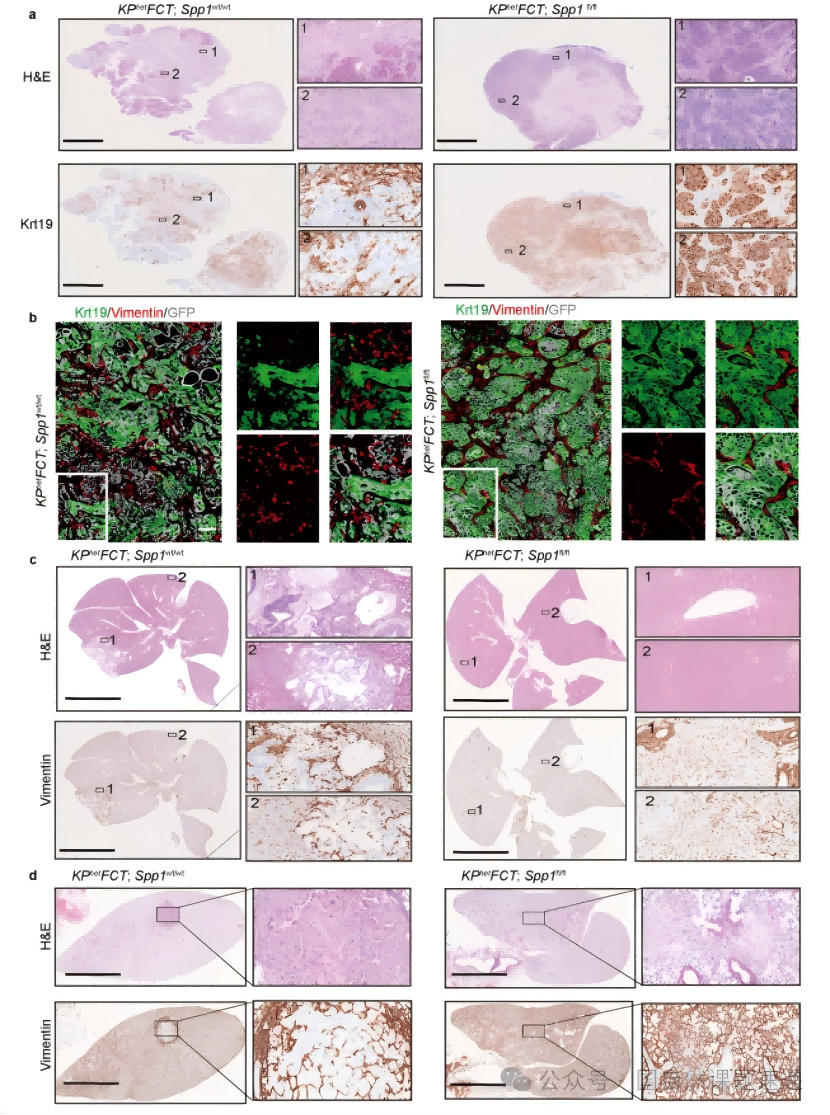
Extended Data 图5 | Spp1丧失抑制 PDAC 发展和转移形成
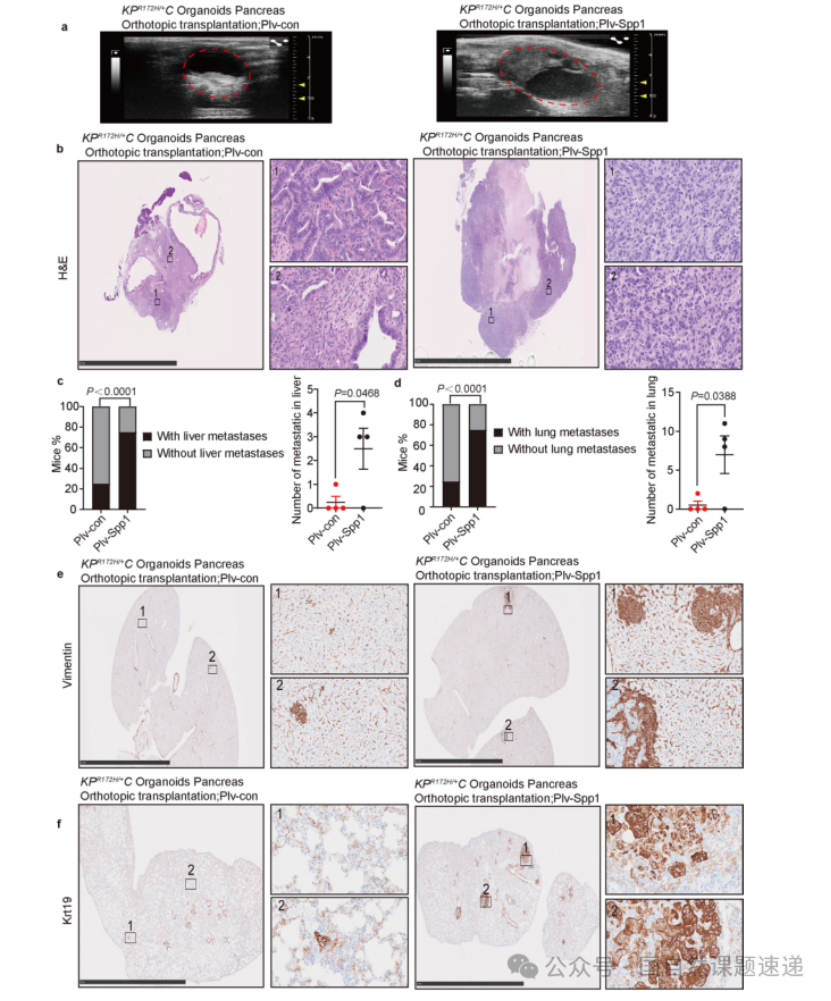
Extended Data 图6 | Spp1过表达促进 PDAC 转移形成
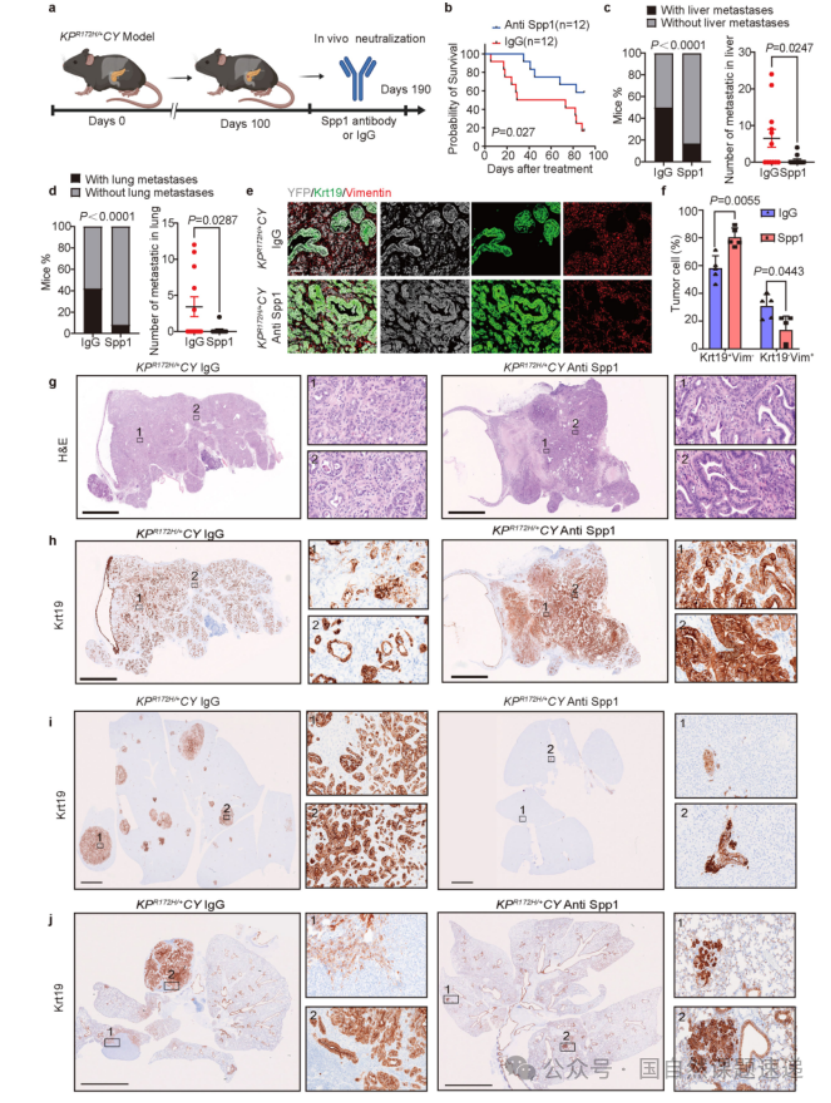
Extended Data 图7 | Spp1抗体治疗诱导上皮分化,通过阻断 MPCs 在胰腺癌中的作用
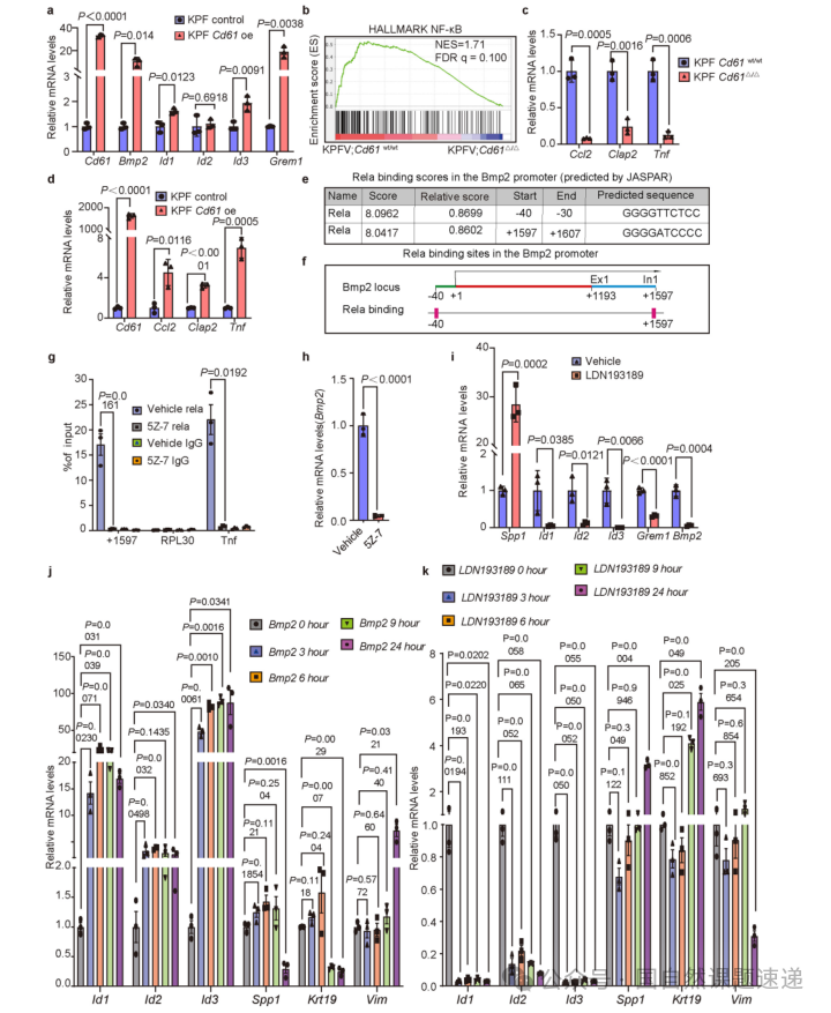
Extended Data 图8 | Spp1和 Bmp2通过调节间充质细胞系的表达间接调控 Spp1
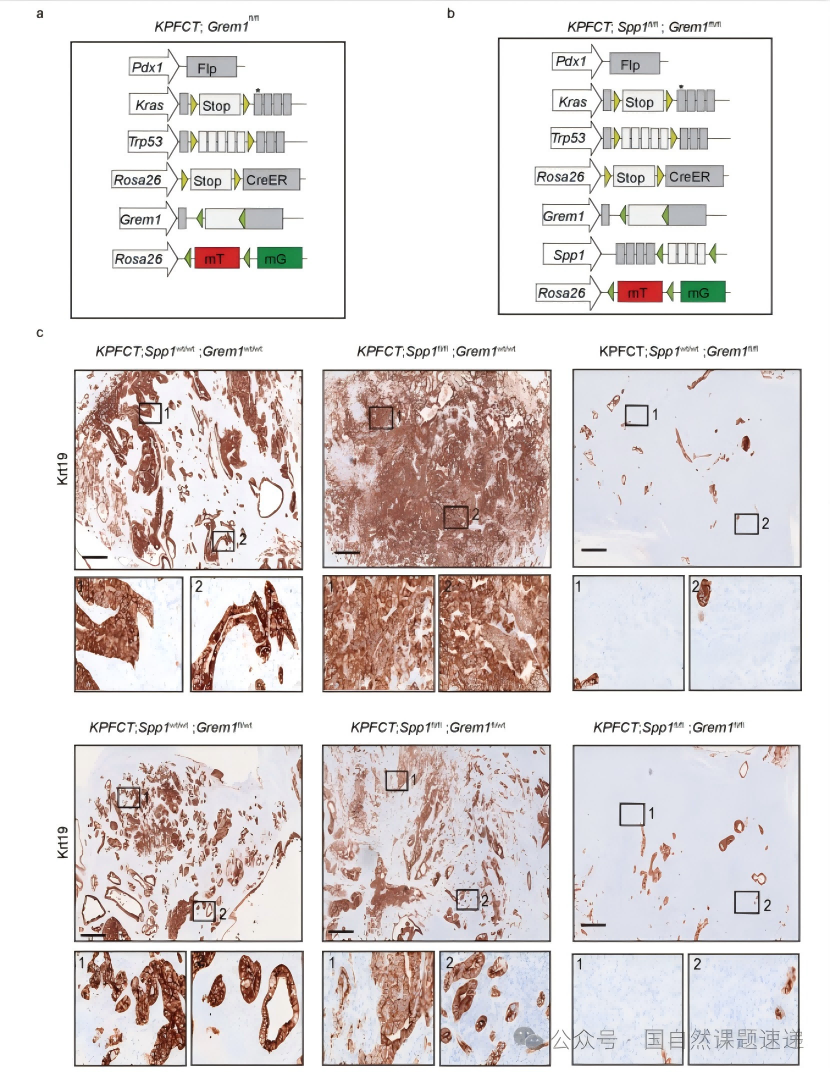
Extended Data 图9 | Spp1和 Grem1复合突变小鼠的组织学分析
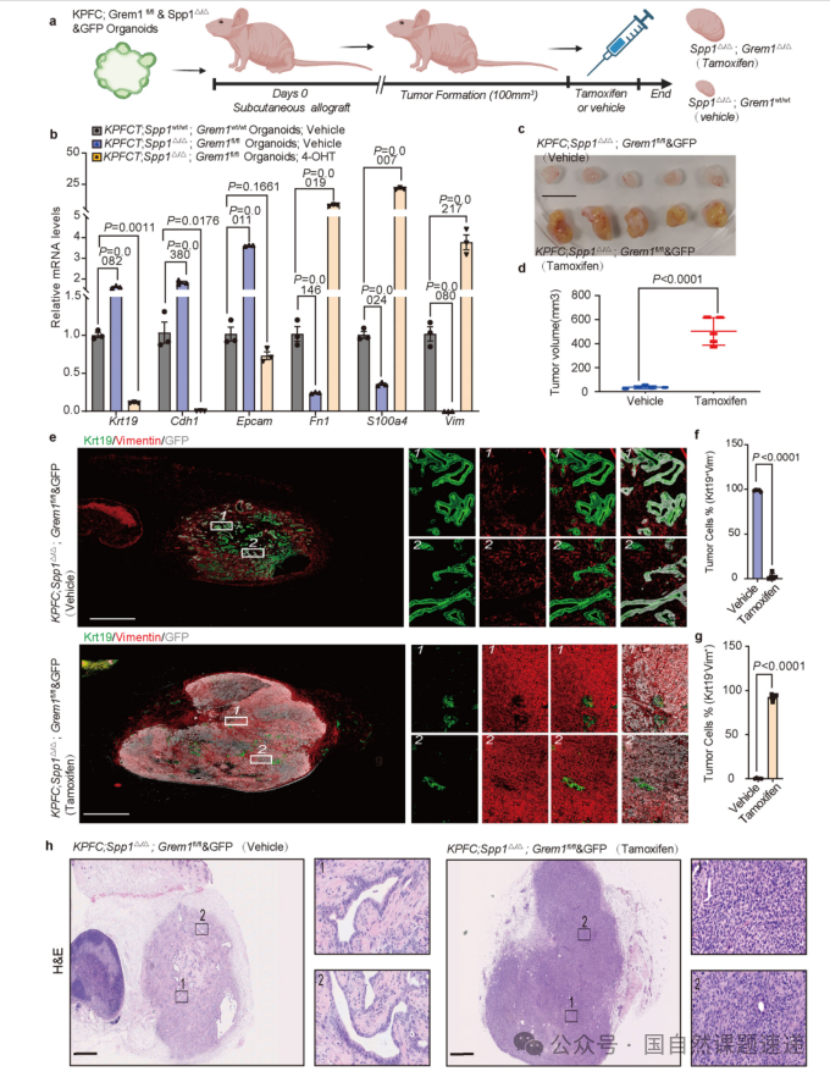
Extended Data 图10 | Grem1删除逆转 Spp1敲除诱导的上皮细胞状态
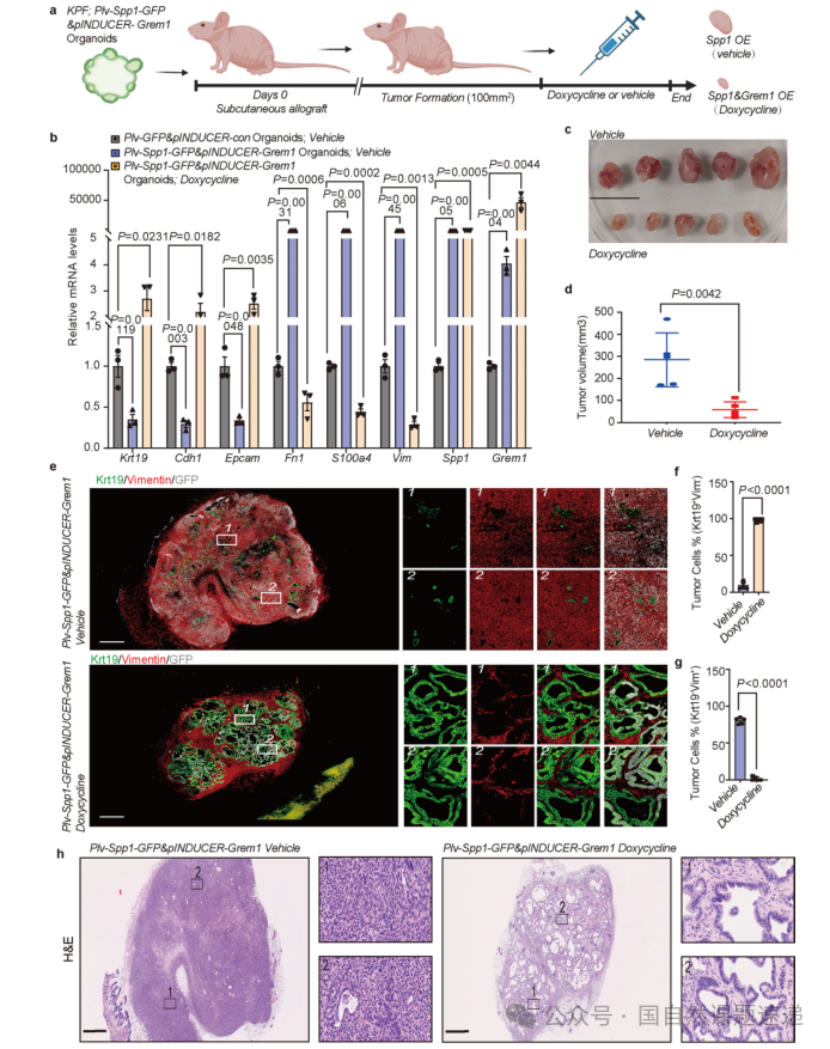
Extended Data 图11 | Grem1过表达逆转最初由 Spp1过表达建立的间充质细胞状态
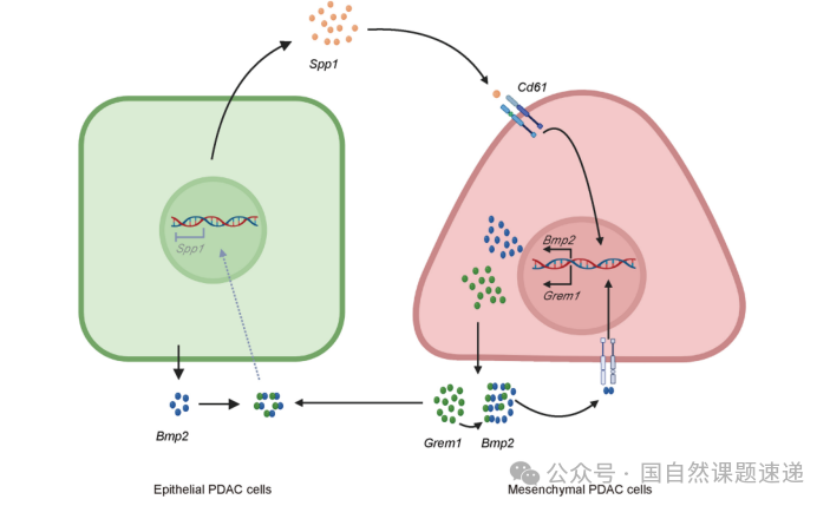
Extended Data 图12 | Spp1、Bmp2和 Grem1在维持胰腺癌细胞异质性中的机制模型
声明:本文使用图片来源于文献,如有侵权请联系删除。