CUSTOMER
客户中心
助力生命健康领域从基础研究到产业化的加速转化
细胞表型转换(phenotypicswitching)指细胞在特定微环境、损伤或信号刺激下,在形态、功能、转录程序与表面分子谱层面发生可逆或部分可逆的状态迁移。它既是发育与修复的生理机制,也是纤维化、肿瘤进展、动脉粥样硬化等多类疾病共同的病理底层逻辑。更现实一点说,把“表型转换”写清楚,往往能把课题从“相关性描述”推到“因果链条验证”,这才是基础研究里更值钱的那一层。
一、上皮-间质转分化(Epithelial-MesenchymalTransition,EMT)
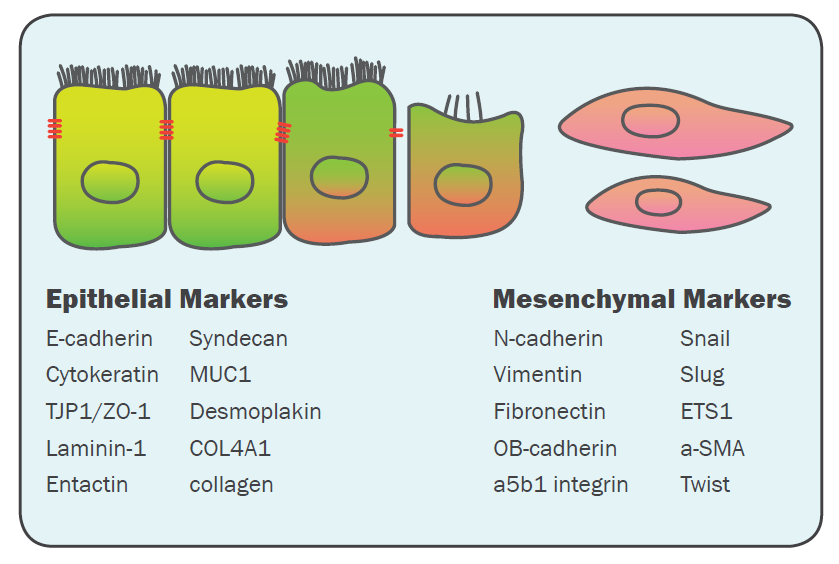
EMT体现为上皮细胞丧失极性与紧密连接,获得间质样迁移与侵袭能力。其过程常呈连续谱而非二元开关,部分EMT状态在肿瘤转移、耐药与纤维化中尤为常见。机制层面,EMT通常由TGF-β/Smad、Wnt/β-catenin、Notch、Hippo/YAP-TAZ等网络共同驱动,并由SNAI1/2(Snail/Slug)、TWIST、ZEB1/2等转录因子重塑上皮基因程序,导致E-cadherin下调与细胞骨架重排,伴随Vimentin、Fibronectin等上调。实验上除分子标志物外,迁移/侵袭功能读出(划痕、Transwell、3D基质侵袭)是把“表型变化”落到“生物学意义”的关键一环。
常用检测指标:E-cadherin、N-cadherin、Vimentin、Fibronectin、SNAI1、SNAI2、TWIST、ZEB1/2;结合IF/Western/qPCR与功能实验综合判定更稳。
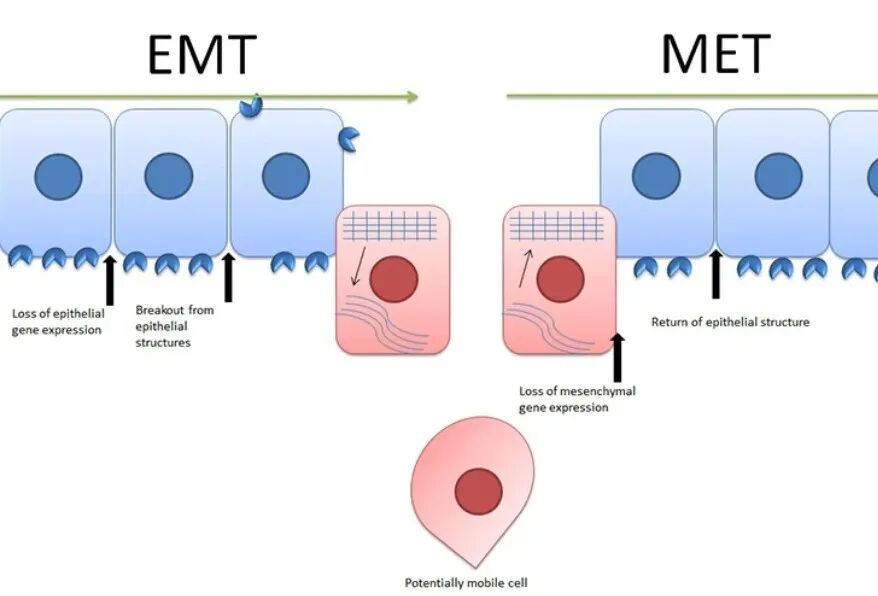
二、间质-上皮转分化(Mesenchymal-EpithelialTransition,MET)
MET可视为EMT逆向迁移,表现为细胞重新建立极性与细胞间连接,上皮连接蛋白恢复,迁移性下降。它在发育、再生及肿瘤远处定植阶段具有解释力。机制上,促进上皮命运的转录调控模块常涉及GATA、KLF、GRHL家族,并伴随紧密连接组分(Claudins、Occludins)与细胞角蛋白(Cytokeratins)上调。研究设计中需要警惕“仅见E-cadherin回升”就下结论,因为细胞可出现混合态或短暂补偿性表达。
常用检测指标:E-cadherin、EpCAM、Claudins、Occludins、Cytokeratins、GATA/KLF/GRHL相关分子;建议加上极性与连接结构成像读出(如ZO-1定位)提升可信度。
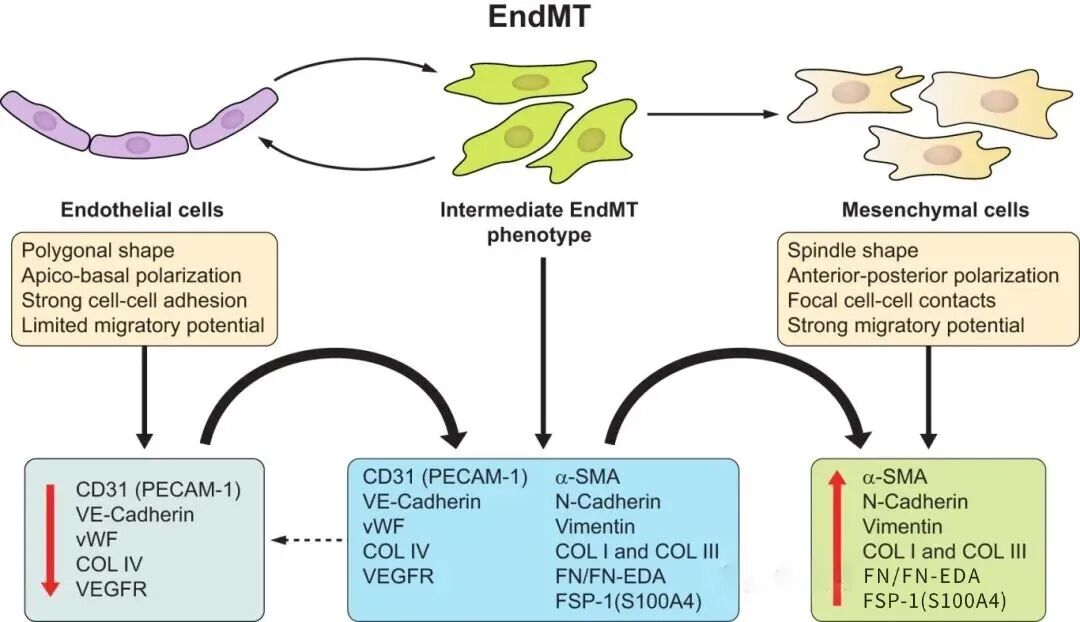
三、内皮-间质转分化(Endothelial-MesenchymalTransition,EndMT)
EndMT指内皮细胞失去内皮特性并获得间质样表型,与心血管发育、纤维化、肿瘤微环境重塑密切相关。典型变化包括内皮标志物(如VE-cadherin、CD31、vWF)降低,间质标志物(N-cadherin、Vimentin、Fibronectin)升高,细胞由铺路石样转为纺锤形并出现应力纤维增强。由于内皮与周细胞/成纤维细胞存在标志物交叉,EndMT研究尤其依赖谱系示踪或单细胞层面的轨迹推断来支撑“来源”证据。
常用检测指标:VE-cadherin、CD31、vWF、N-cadherin、Vimentin、Fibronectin,以及SNAI1/2、TWIST、ZEB等;建议在动物模型中叠加谱系示踪提高因果强度。
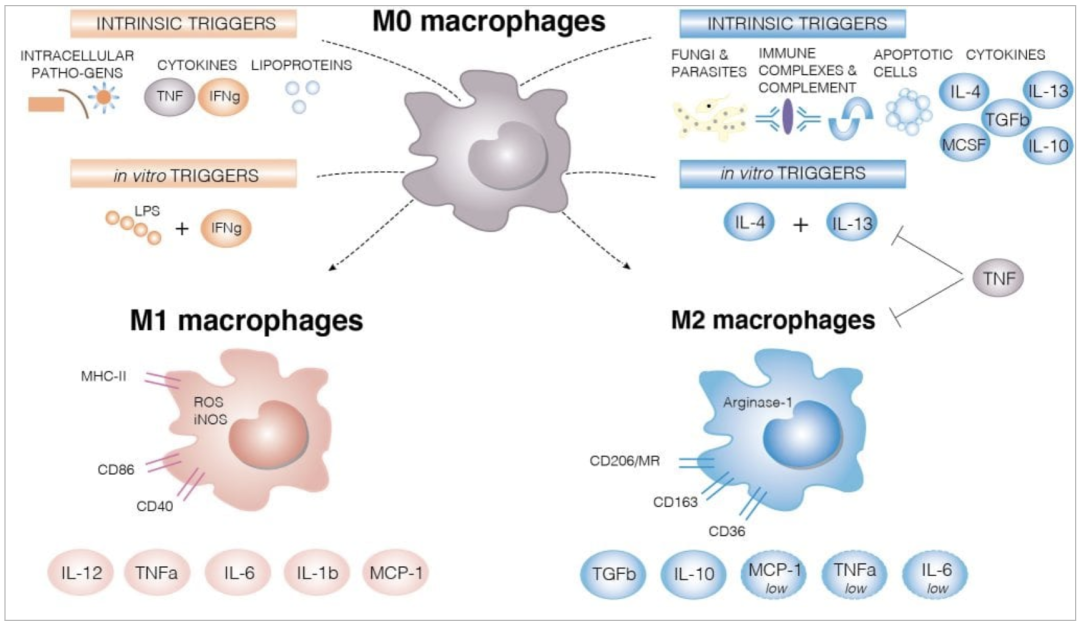
四、巨噬细胞M1-M2分化(促炎-抗炎极化)
巨噬细胞极化反映免疫微环境对先天免疫效应的重编程。M1样状态常由LPS、IFN-γ等驱动,产生TNF-α、IL-1β、IL-6、IL-12并增强ROS/NO介导的杀伤;M2样状态常由IL-4、IL-13等驱动,上调IL-10、TGF-β并参与修复、血管生成与免疫调节。需要直说的一点:真实组织里的巨噬细胞通常不是标准M1或M2,更像连续谱与混合功能,因此仅凭单一标志物很容易“贴标签过度”。
常用检测指标:M1相关TNF-α、IL-1β、IL-6、IL-12,Nos2等;M2相关IL-10、TGF-β,Arg1、Fizz1、Cd206等;表面分子可用CD86/MHCII(M1样)、CD206/CD163/CD200R(M2样)。建议流式/单细胞转录组+细胞因子谱联合判定。
五、成纤维细胞活化(FibroblastActivation)
成纤维细胞从静止态转入高增殖、高迁移与高ECM合成状态,是瘢痕形成与纤维化进展的核心事件。活化过程中常见TGF-β、PDGF、FGF等信号增强,α-SMA上调并出现肌成纤维细胞(myofibroblast)特征,ECM组分(胶原、Fibronectin、透明质酸相关通路)显著增加。这里的坑在于:不同组织来源成纤维细胞异质性极强,同一标志物在不同器官可代表不同亚群,因此最好以“亚群-功能-空间定位”三件套来组织证据。
常用检测指标:α-SMA、COL1A1/COL3A1等胶原轴、Fibronectin、TGF-β通路读出,以及增殖/迁移与胶原沉积功能评估。
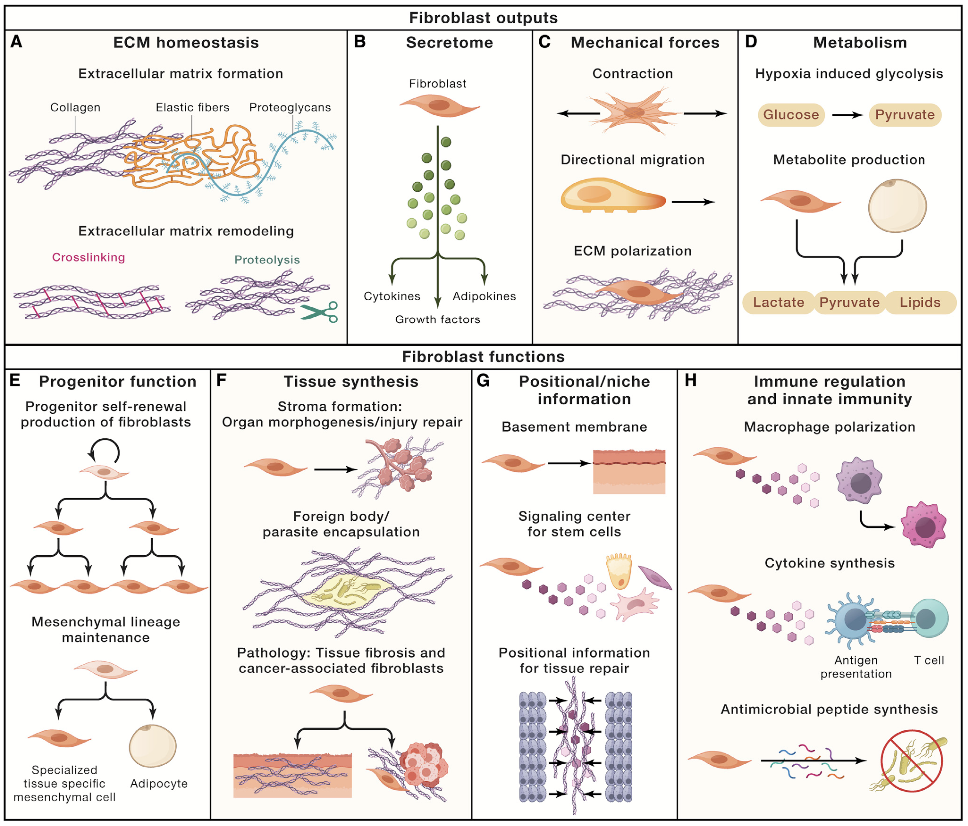
六、血管平滑肌细胞(VSMCs)收缩-合成表型转换
VSMCs可在损伤、炎症、脂质沉积等刺激下由收缩表型向合成表型迁移。收缩态以维持血管张力为主,高表达α-SMA、MYH11等收缩装置;合成态则增强增殖迁移与ECM/炎症因子生成,收缩蛋白下降并出现表面分子谱变化(如CD44、PDGFR-β等在部分语境下被观察到)。研究上应避免把“α-SMA下降”简单等同于“合成化完成”,因为细胞可能处在过渡态,甚至出现向成骨样/巨噬样方向的异常分化轨迹,尤其在动脉粥样硬化斑块环境中更常见。
常用检测策略:形态学+α-SMA/MYH11等收缩标志+增殖(BrdU/EdU)+迁移(划痕/Transwell)+ECM分泌与炎症因子(ELISA/芯片)的组合读出,再用单细胞轨迹或空间转录组补强“状态迁移”的证据链。
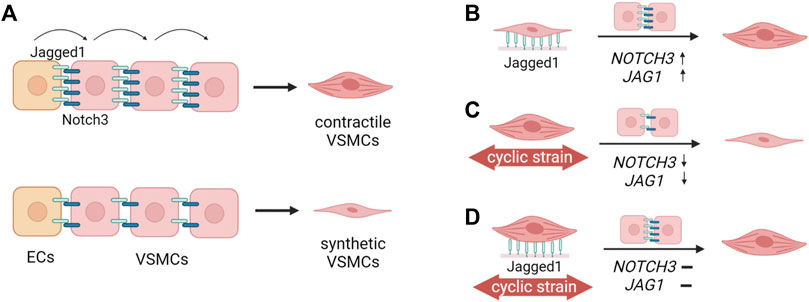
七、成骨-成脂转分化(Osteogenic-AdipogenicTransition)
该类转分化常见于骨髓间充质干细胞或成骨谱系前体在微环境与代谢信号影响下偏向成脂命运,与骨质疏松、代谢异常及骨修复不良相关。其关键特征包括成骨活性下降(ALP降低、矿化结节减少、Runx2/Osterix/骨钙素等轴减弱)与成脂程序增强(PPARγ、C/EBPα、脂联素上调,脂滴积累)。机制研究中,把“命运偏转”与“微环境因子”(炎症、力学、激素、线粒体代谢)做耦合,通常比单独描述标志物更能形成可检验假说。
常用检测指标:成骨ALP、Runx2、Osterix、OCN、OPN;成脂PPARγ、C/EBPα、Adiponectin与脂滴染色(OilRedO);建议加入矿化染色(AlizarinRed)与脂滴定量实现双向功能验证。
结语
想把文章或标书写得更像文献,核心不是多堆几个Marker,而是把证据层级拉齐:分子标志物(表达)→结构改变(定位/形态)→功能读出(迁移、分泌、收缩、矿化等)→来源与轨迹(谱系示踪/单细胞轨迹/空间证据)→关键节点干预(通路抑制或遗传操作)形成闭环。否则很容易停在“看起来像”的阶段,说服力就会被审稿人或评审一眼看穿。你如果后面要把这篇进一步升级成“可直接塞进国自然立项依据/研究内容”的版本,我也可以按“科学问题→假说→技术路线→关键指标与替代方案”的写法把每种转换整理成可落地的研究模块。
声明:本文使用图片来源于网络和文献,如有侵权请联系删除。