CUSTOMER
客户中心
助力生命健康领域从基础研究到产业化的加速转化
合适给药剂量的确认
在进行正式的动物实验前,通常会先进行少量动物(如小鼠)的剂量摸索实验,以大致确定中毒剂量或致死剂量。接着,可以选择小于中毒剂量或致死剂量的若干个千分之一剂量进行初步实验,通常剂量范围在1/10到1/5之间。如果药物为植物药粗制剂,则剂量一般按生药进行折算;如果是化学药物,其剂量可以参考已知结构或与之结构和功能相似的药物剂量。当然,最终的剂量确定仍需根据动物的反应程度进行调整,并且不同给药途径下,动物的剂量也会有所不同。
实验动物用药量的计算
在动物实验中,用药剂量通常按mg/kg体重或g/kg体重来计算。根据已知药物的浓度,可以换算成ml/kg体重。对于大鼠和小鼠,还需要进一步换算成大鼠ml/100g体重和小鼠ml/10g体重。一般来说,大鼠的用药量为0.2ml/10g体重,而小鼠则为0.1ml/10g体重。这样换算后,可以确保不同体重的动物能够接受到适当的药物剂量。
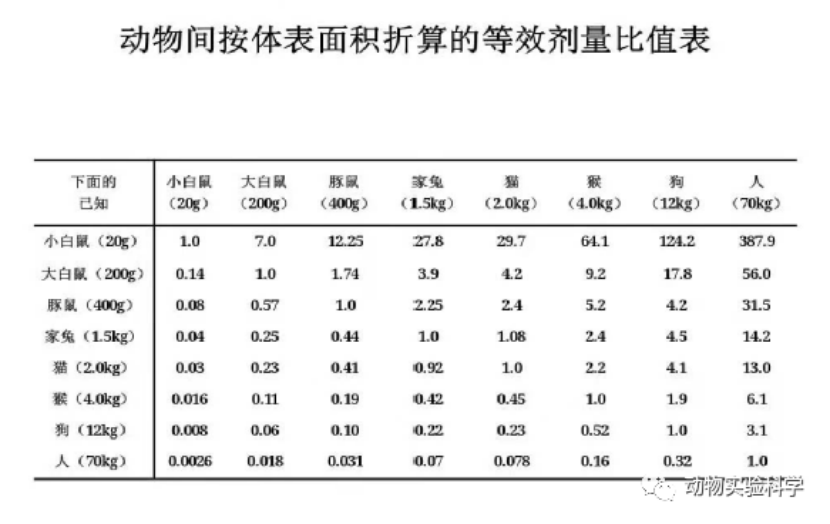
人与实验动物用药量的换算
确实,人体和动物对药物的耐受性存在较大差异。通常情况下,动物的耐受性要高于人类,因此单位体重的动物所需的药物剂量通常会比人类要大。为了进行动物实验剂量的换算,通常使用体表面积换算或体重换算这两种方法。
体表面积换算方法考虑到动物与人之间的代谢差异,能够更准确地反映药物在体内的分布和作用。常用的换算公式是:

其中,体表面积可以通过以下公式估算:

此外,也可以使用体重换算方法,通常通过简单的体重比例来进行药物剂量的换算。不过,体表面积换算通常会更为精确,特别是在药物的药代动力学差异较大时。
如果有具体的体表面积换算表,通常可以根据不同动物种类和人类的体表面积进行调整,以确定适合的药物剂量。
给药途径和方法
给药途径大致分为皮内注射、皮下注射、肌肉注射、腹腔注射、静脉注射、经口给药、皮肤给药、脑内给药、心脏穿刺给药等。
皮内注射
大小鼠的皮内注射操作基本一致,这里以小鼠为例进行说明。常选背部脊柱两侧的皮肤作为注射部位。注射前需使用脱毛剂或剃毛器清除该区域的毛发,并用酒精棉球消毒皮肤表面。操作时,左手轻轻捏起皮肤,右手使用带有5号或更细针头的注射器,保持针头斜面朝上,以约30°角缓慢刺入皮肤层,同时略微上挑,缓慢推注药液。注射成功后,皮肤表面会形成一个小包块并显现苍白,一般小鼠的皮内注射体积不宜超过0.05ml。
皮下注射
大小鼠皮下注射操作大致相同,小鼠常选颈背部,大鼠则可选择颈背部、左下腹或后腿皮肤作为注射部位。注射前可用剃毛器清除被毛,或不剃毛直接用酒精棉球或碘伏消毒皮肤。操作时,左手抓握动物并提起注射部位皮肤,右手持注射器(建议使用6号针头或更细),保持针头斜面朝上,以合适角度刺入皮下。刺入时能感到明显的穿刺感,针头若能在皮下左右轻松晃动,说明已成功进入皮下组织。此时缓慢推注药液,可见局部形成一个小包,稍后会自行吸收消退。注射完成后,缓慢拔出针头,并用手指或眼科镊轻压针孔,防止药液回流。
大鼠皮下单次注射-0.2~0.5ml/100g。
小鼠皮下单次注射-0.1~0.3ml/10g。
肌肉注射
肌肉注射通常用于对给药途径有特定要求的药物,或用于不溶或难溶于水的制剂。注射部位应选择肌肉发达且血管较少的区域,常规为臀部。但由于大小鼠后肢肌肉量较少,一般不推荐肌肉注射;若实验设计确需此途径,应由两人配合完成,一人保定动物,另一人进行注射操作。
注射前,用酒精棉球或碘伏对注射部位进行消毒。注射时,使用6号针头或更细型号的注射器,选取大鼠或小鼠后肢的内侧或外侧大腿肌肉为注射部位。刺入后轻微回抽,如无血液回流则说明未刺入血管,可缓慢注入药液。注射后应观察局部反应,避免组织损伤或渗漏。
大鼠单次注射量≤0.3ml。
小鼠单次注射量≤0.1ml。
腹腔注射
腹腔注射是大小鼠常用的一种给药方式,操作相对便捷,通常单人即可完成,初学者建议两人配合进行。
操作前,左手抓稳并保定动物,使其头部朝下、尾部朝上,便于腹腔展开。用酒精棉球或碘伏对预定注射区域进行消毒,注射部位通常选择腹中线稍偏左或偏右的位置,避开膀胱、肠道和大血管。右手持注射器(建议使用5号针头或更细),以约45°角刺入腹腔。刺入时会有轻微的穿刺感,感到阻力消失即为进入腹腔。此时轻轻回抽,如未见液体或血液回流,即可缓慢注入药物。注射完成后,可用棉球轻压注射部位,防止渗漏。
大鼠单次注射量为1.0~2.0ml/100g。
小鼠单次注射量为0.1~0.2ml/10g。
静脉给药
大小鼠尾静脉共有3条,分别位于尾部左右两侧和背侧。因左右两侧静脉角质层较薄,便于固定与观察,因此通常选作注射部位。
注射前,将动物放入专用固定器内,使尾部自然外露。左手抓住尾尖,使尾巴保持拉直状态,用酒精棉球擦拭尾部静脉(小白鼠从尾根向尾尖方向单向擦拭,黑鼠和大鼠可上下反复擦拭以扩张血管)。右手持注射器(5号针头及以下),将针头斜面朝上,使其与尾静脉走向基本平行,并与尾部形成一定夹角刺入。成功刺入时可感觉明显“落空感”,初学者也可轻轻回血确认是否进针。随后缓慢推注药液,若无阻力可完成注射。
注射结束后,用棉球按压针口止血。最好从尾尖部位开始注射,如需多次注射,应逐步向尾根部移动,以避免血管损伤或堵塞。
小鼠单次注射量为0.1~0.2ml/10g。
大鼠单次注射量为0.3~0.5ml/100g。
大鼠阴茎静脉注射
对于有特定给药需求的实验,可选择大鼠阴茎静脉注射作为静脉给药方式。
操作前需对大鼠进行麻醉,使其处于仰卧位。轻轻翻开包皮,拉出阴茎,可见阴茎背侧存在一条粗大的静脉,作为注射目标。
注射前,用碘伏棉球对注射部位进行充分消毒。左手固定阴茎,右手持注射器(建议使用5号针头或更细),保持针头斜面朝上,直接刺入可视静脉,确认进针位置无误后缓慢推注药液,完成注射即可。操作过程中应注意动作轻柔,避免局部组织损伤或出血。
经口给药
经口给药可分为自动口服给药(将药物混入水或饲料中,动物自己觅食)、被动口服给药(灌胃)。
自动口服给药
操作简单,但因动物个体差异,采食量有差异,药量难以精准控制,故此法应用较少。
被动口服给药(灌胃)
此法因为是借助灌胃器具将药物直接灌入动物胃内,所以此法可以精准给药,灵活控制给药剂量,是实际实验中常用的给药方式。但此法操作不当可能会引起动物死亡。对于大小鼠,在进行灌胃时,应先用左手将动物保定,并调整至合适姿势,使口、咽、食道成直线状,选用合适型号的灌胃针与合适量程的注射器,组合成灌胃器,右手手持灌胃器,使灌胃针沿嘴角轻轻插入食管(进针时可灵活活动,寻找合适位置进针,进针平顺无阻碍)。如动物无呼吸异常,无挣扎呕吐,则证明灌胃针已进入胃内,可推注完成给药。灌胃完成,拔出灌胃针即可。
大鼠单次灌胃量为1.0~2.0ml/100g。
小鼠单次灌胃量为0.1~0.3ml/10g。
皮肤给药
皮肤给药主要用于研究药物通过皮肤的吸收能力及其对皮肤的局部作用、致敏性、光敏性等影响。在大小鼠实验中,常采用浸尾法作为常规的皮肤给药方式,主要用于定性评估药物的经皮吸收效果。
操作时,将动物放入专用固定器(如尾静脉注射固定器),使尾部自然外露。将鼠尾浸入准备好的药液中,可根据实验要求在特定通风橱内完成操作。浸泡一定时间后,观察动物局部或系统性反应以评估药物效果。
若所用药物为有毒或易挥发性物质,应将药液放置于密封容器内,鼠尾从开口处插入并完成浸泡,操作全程需在通风橱内进行。同时,实验人员必须佩戴防毒面罩,注意个体安全与实验室防护措施。
脑内给药
脑内给药在动物实验中应用较少,通常用于特定药物的中枢给药或执行如帕金森病模型等特殊实验。
基本操作为:将动物麻醉后,使用碘伏对颅部进行擦拭消毒。左手对动物头部进行简单固定,在两耳连线与两眼前缘连线的交叉区域中点作为注射部位参考。右手持注射器(细针头),从右侧颅部中部垂直刺入,深度约为2~3mm,缓慢注入药物。
如需精准定位注射至特定脑区,则必须借助脑立体定位仪。该方法包括:
①麻醉动物并固定于脑立体定位装置中;
②清洁消毒头部皮肤,剥离皮层暴露颅骨;
③使用电钻在颅骨标记点打孔;
④通过三维坐标调节注射针至目标脑区,准确注射药物。
该方法适用于对给药位置及剂量精度要求极高的神经科学研究,操作需严格、精准,建议由专业人员完成。
心脏穿刺给药
心脏穿刺属于特殊用途的给药方式,由于穿刺会对心脏组织造成损伤,且药物会迅速通过血液循环全身,易引发较大副作用,因此常规实验中不推荐使用,仅在某些特殊实验或技术要求下采用。
操作方法:
操作前,将动物以灌胃姿势进行保定,左手固定。用酒精棉球对剑突右侧与肋骨交界处的皮肤区域进行消毒。
右手持注射器(建议使用细号针头),针头紧贴剑突与右肋骨形成的夹角位置,快速刺入体内。当针尖接触到心脏表面,会感受到明显的搏动感,此时略微前送针头,如有轻微回血即表明成功进入心腔,可缓慢推注药液完成给药。
注意事项:
本法操作风险较高,禁止反复穿刺,否则极易引起心脏穿孔或出血,导致动物死亡;
建议仅在实验设计明确要求心腔给药的情况下使用;
操作者需熟练掌握动物解剖位置与手感判断,避免误伤心外膜或穿透心脏组织;
一般用于需高效全身分布但无其他合适途径的特定药物或终末处理实验。
声明:本文使用图片来源于网络和文献,如有侵权请联系删除。