CUSTOMER
客户中心
助力生命健康领域从基础研究到产业化的加速转化
From:Nature medicine,IF=50
Abstract
In contrast to chimeric antigen receptor T cells, T cell receptor (TCR)-engineered T cells can target intracellular tumor-associated antigens crucial for treating solid tumors. However, most trials published so far show limited clinical activity. Here we report interim data from a first-in-human, multicenter, open-label, 3 + 3 dose-escalation/de-escalation phase 1 trial studying IMA203, an autologous preferentially expressed antigen in melanoma (PRAME)-directed TCR T cell therapy in HLA-A*02+ patients with PRAME+ recurrent and/or refractory solid tumors, including melanoma and sarcoma. Primary objectives include the evaluation of safety and tolerability and the determination of the maximum tolerated dose (MTD) and/or recommended dose for extension. Secondary objectives include the evaluation of IMA203 TCR-engineered T cell persistence in peripheral blood, tumor response as well as duration of response. A total of 27 patients were enrolled in the phase 1a dose escalation and 13 patients in the phase 1b dose extension. IMA203 T cells were safe, and the MTD was not reached. Of the 41 patients receiving treatment (that is, who started lymphodepletion), severe cytokine release syndrome was observed in 4.9% (2/41), and severe neurotoxicity did not occur. In the 40 patients treated with IMA203, an overall response rate consisting of patients with unconfirmed or confirmed response (u/cORR) of 52.5% (21/40) and a cORR of 28.9% (11/38) was observed with a median duration of response of 4.4 months (range, 2.4–23.0, 95% confidence interval: 2.6–not reached) across multiple indications. Rapid T cell engraftment and long-term persistence of IMA203 T cells were observed. IMA203 T cells trafficked to all organs, and confirmed responses were more frequent in patients with higher dose. T cell exhaustion was not observed in the periphery; deep responses were enriched at higher PRAME expression; and higher T cell infiltration resulted in longer progression-free survival. Overall, IMA203 showed promising anti-tumor activity in multiple solid tumors, including refractory melanoma. ClinicalTrials.gov identifier: NCT03686124.
摘要
与嵌合抗原受体T细胞(CAR-T细胞)不同,T细胞受体(TCR)工程化T细胞能够靶向细胞内肿瘤相关抗原,这对于治疗实体瘤至关重要。然而,迄今为止发表的大多数试验显示其临床活性有限。在此,我们报告了一项首次人体、多中心、开放标签、3+3剂量递增/递减的1期临床试验的中期数据,该试验研究了IMA203,一种针对黑色素瘤优先表达抗原(PRAME)的自体TCR T细胞疗法,用于治疗HLA-A*02+且PRAME+的复发和/或难治性实体瘤患者,包括黑色素瘤和肉瘤。主要目标包括评估安全性、耐受性,并确定最大耐受剂量(MTD)和/或扩展研究的推荐剂量。次要目标包括评估IMA203 TCR工程化T细胞在外周血中的持久性、肿瘤反应以及反应持续时间。
在1a期剂量递增阶段共纳入了27名患者,1b期剂量扩展阶段纳入了13名患者。IMA203 T细胞治疗安全,未达到最大耐受剂量。在41名接受治疗的患者(即开始淋巴细胞清除的患者)中,观察到4.9%(2/41)出现严重的细胞因子释放综合征,未观察到严重的神经毒性。在40名接受IMA203治疗的患者中,观察到总体反应率为52.5%(21/40,包括未确认和已确认的反应),已确认的反应率为28.9%(11/38),中位反应持续时间为4.4个月(范围为2.4至23.0个月,95%置信区间:2.6至未达到),这一结果涵盖了多种适应症。IMA203 T细胞表现出快速的细胞嵌合和长期的持久性。IMA203 T细胞能够迁移到所有器官,且在高剂量组中观察到更多的确认反应。在外周血中未观察到T细胞耗竭;在PRAME高表达的患者中观察到更深度的反应;更高的T细胞浸润与更长的无进展生存期相关。总体而言,IMA203在多种实体瘤(包括难治性黑色素瘤)中显示出有希望的抗肿瘤活性。
内容总结
这篇文章是一项关于IMA203(一种针对PRAME+实体瘤的自体TCR T细胞疗法)的1期临床试验的中期分析报告。研究团队通过这项首次人体、多中心、开放标签的剂量递增/递减试验,评估了IMA203的安全性、耐受性、最大耐受剂量(MTD)和推荐扩展剂量,并初步探讨了其在多种复发和/或难治性实体瘤中的抗肿瘤活性。
研究背景
T细胞受体(TCR)工程化T细胞能够靶向细胞内肿瘤相关抗原,对于治疗实体瘤具有重要意义。
与CAR-T细胞相比,TCR T细胞能够靶向由人类白细胞抗原(HLA)呈递的细胞内肿瘤抗原。
PRAME(优先表达于黑色素瘤的抗原)是一种癌症/睾丸抗原,在多种实体瘤中表达,但在正常组织中表达有限。
研究方法
患者选择:研究纳入了HLA-A*02+且PRAME+的复发和/或难治性实体瘤患者,包括黑色素瘤和肉瘤。
剂量递增/递减设计:试验采用3+3剂量递增/递减设计,共分为两个阶段:1a期剂量递增和1b期剂量扩展。
治疗方案:患者接受淋巴细胞清除预处理后,接受IMA203 T细胞输注,并接受IL-2治疗。
主要终点:评估安全性、耐受性、MTD和推荐扩展剂量。
次要终点:评估IMA203 T细胞在外周血中的持久性、肿瘤反应和反应持续时间。
实验结果
安全性:共41名患者接受了治疗,IMA203 T细胞显示出良好的安全性,未达到MTD。4.9%(2/41)的患者出现严重的细胞因子释放综合征(CRS),未观察到严重的神经毒性。
抗肿瘤活性:在40名接受IMA203治疗的患者中,总体反应率(包括未确认和已确认的反应)为52.5%(21/40),已确认的反应率为28.9%(11/38)。中位反应持续时间为4.4个月,范围为2.4至23.0个月。
T细胞持久性:观察到IMA203 T细胞的快速嵌合和长期持久性,部分患者在外周血中检测到IMA203 T细胞超过2年。
T细胞浸润:IMA203 T细胞能够迁移到所有器官,且在高剂量组中观察到更多的确认反应。T细胞浸润与更长的无进展生存期相关。
关键结论
IMA203在多种实体瘤中显示出有希望的抗肿瘤活性,包括难治性黑色素瘤。
IMA203 T细胞的安全性和耐受性良好,未观察到治疗相关死亡。
高剂量IMA203 T细胞治疗与更高的反应率和更长的反应持续时间相关。
T细胞浸润和PRAME表达水平是预测治疗反应的重要因素。
研究意义
该研究为TCR T细胞疗法在实体瘤治疗中的应用提供了重要的临床数据支持。
IMA203显示出良好的安全性和初步的抗肿瘤活性,为后续的临床研究奠定了基础。
研究结果强调了优化TCR亲和力、实现合适剂量和设计制造过程的重要性,这些因素对于提高T细胞疗法的疗效至关重要。
未来方向
进一步的临床试验将评估IMA203在更大患者群体中的疗效和安全性。
研究将探索IMA203与其他免疫检查点抑制剂的联合治疗潜力。
长期随访研究将有助于更好地理解IMA203 T细胞的持久性和患者的长期预后。
图文摘要

图 1|CONSORT流程图
展示从筛选399例患者至最终40例接受IMA203治疗的全过程,包括筛选失败原因分层。
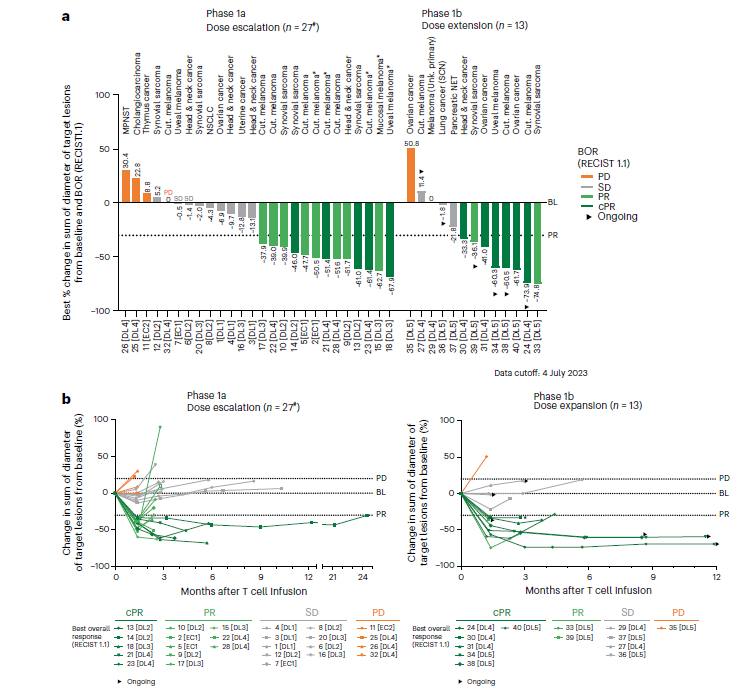
图 2|IMA203在多种实体瘤中诱导深度客观缓解,并在黑色素瘤中呈现深度持久缓解
a.分别展示剂量递增阶段(n=27)和剂量扩展阶段(n=13)每例患者靶病灶直径最佳百分比变化的瀑布图,并标注最佳总体缓解(BOR)。
b.展示上述两阶段患者随时间变化的靶病灶直径百分比变化曲线,颜色代表BOR。
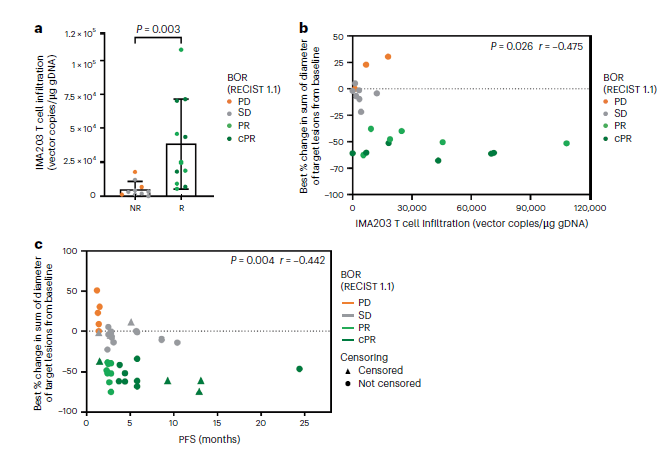
图 3|最佳总体缓解及缓解深度与肿瘤内T细胞浸润高度相关
a.箱线图比较应答者与非应答者在第42天肿瘤活检中IMA203 T细胞浸润程度(vector copies/μg gDNA)。
b.散点图显示每例可评估患者T细胞浸润水平与其靶病灶最大缩小百分比的相关性。
c.散点图显示靶病灶最大缩小百分比与PFS的Spearman相关性。
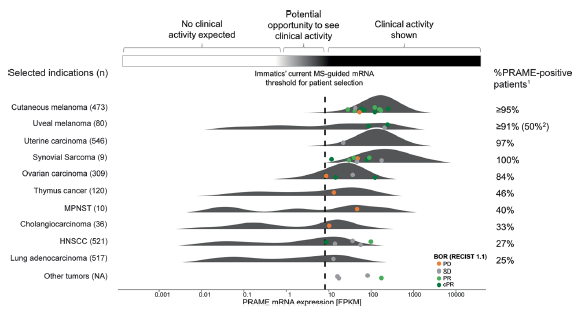
扩展图 1|PRAME mRNA在多种肿瘤中呈单峰表达
利用TCGA RNA-seq数据及本研究qPCR结果,展示PRAME在各瘤种的表达分布及阳性率,并标注入组患者的BOR。
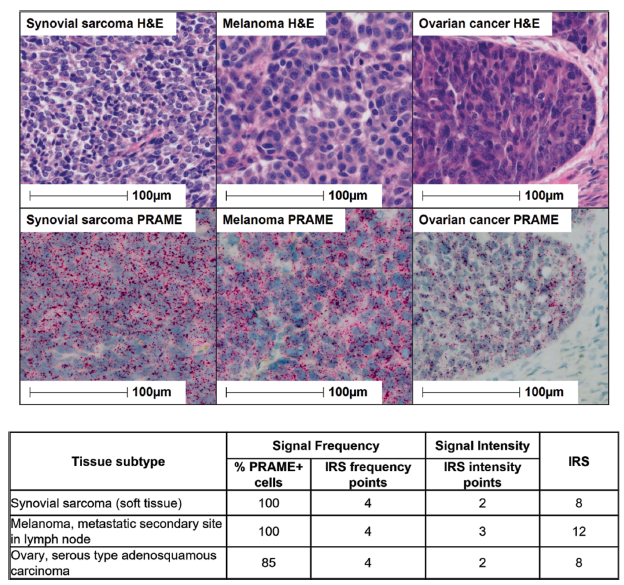
扩展图 2|PRAME在多种肿瘤组织中呈均一表达
RNAscope原位杂交显示PRAME mRNA(红色点状信号)在肿瘤区域均一分布,并给出免疫反应评分(IRS)。
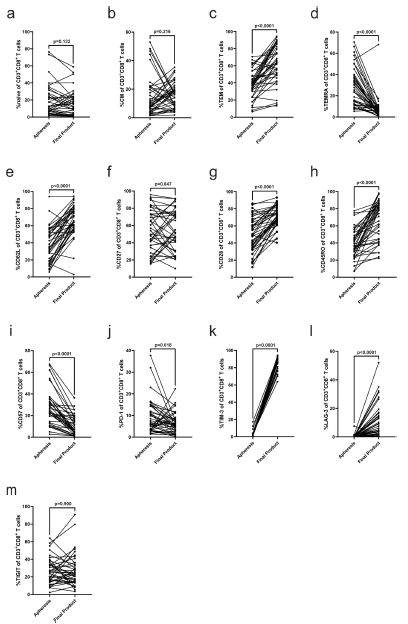
扩展图 3|制备工艺富集了具有良好共刺激表型的效应记忆T细胞配对
比较40例患者外周血起始样本与最终IMA203产品在CD8+T细胞不同记忆亚群及功能/耗竭标志物上的表达差异。
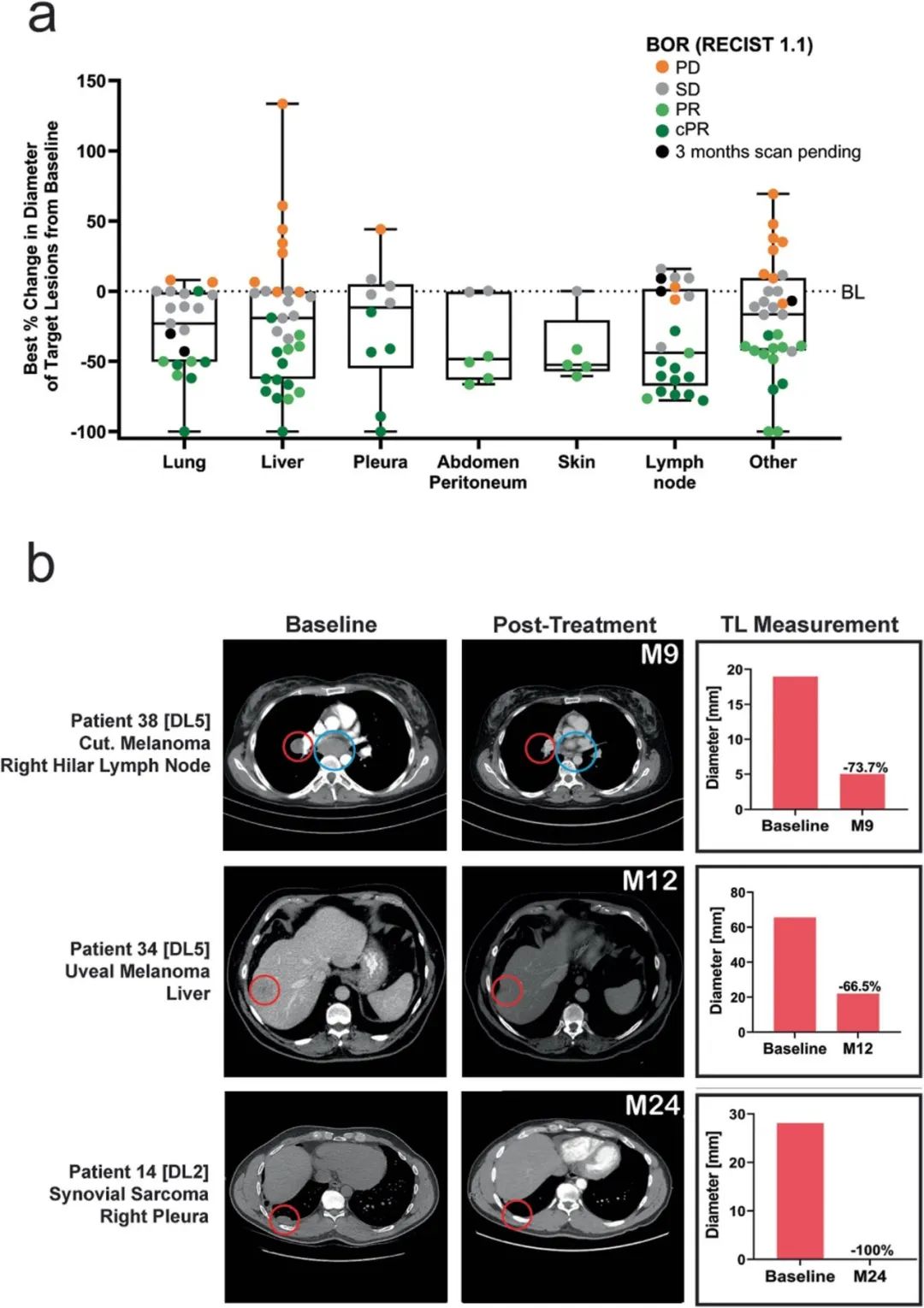
扩展图 4|IMA203治疗后全身多部位转移灶缩小
a.箱线图展示不同器官(肺、肝、胸膜、腹膜、皮肤、淋巴结等)靶病灶最佳缩小百分比。
b.3例患者(黑色素瘤、葡萄膜黑色素瘤、滑膜肉瘤)的基线与治疗后CT影像示例。
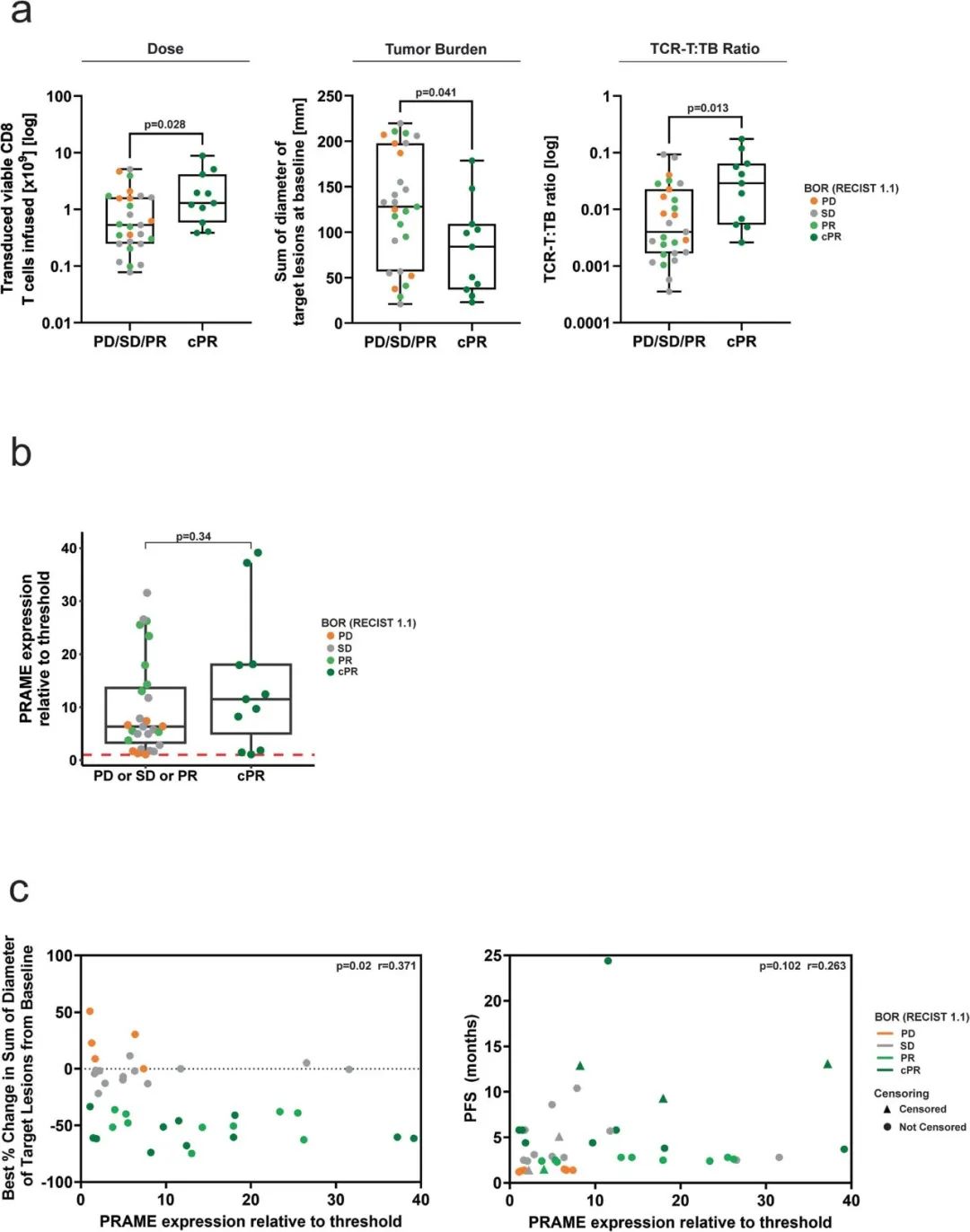
扩展图 5|更高TCR-T剂量、剂量-肿瘤负荷比、PRAME表达及更低肿瘤负荷与持久缓解相关
a.比较应答与非应答组在TCR-T剂量、肿瘤负荷、剂量-负荷比上的差异。
b.比较两组PRAME mRNA表达水平(相对于阈值)。
c.散点图展示PRAME表达与靶病灶缩小百分比及PFS的相关性。
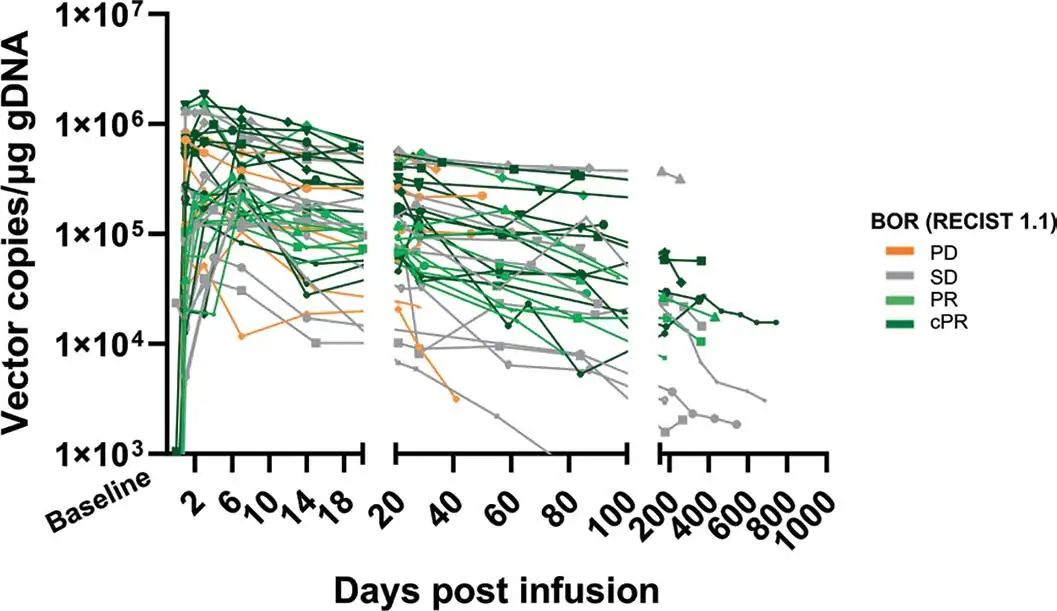
扩展图 6|IMA203 T细胞快速植入并长期持续存在
qPCR结果显示IMA203 T细胞在PBMC中的动力学,最长随访743天仍可检测到。
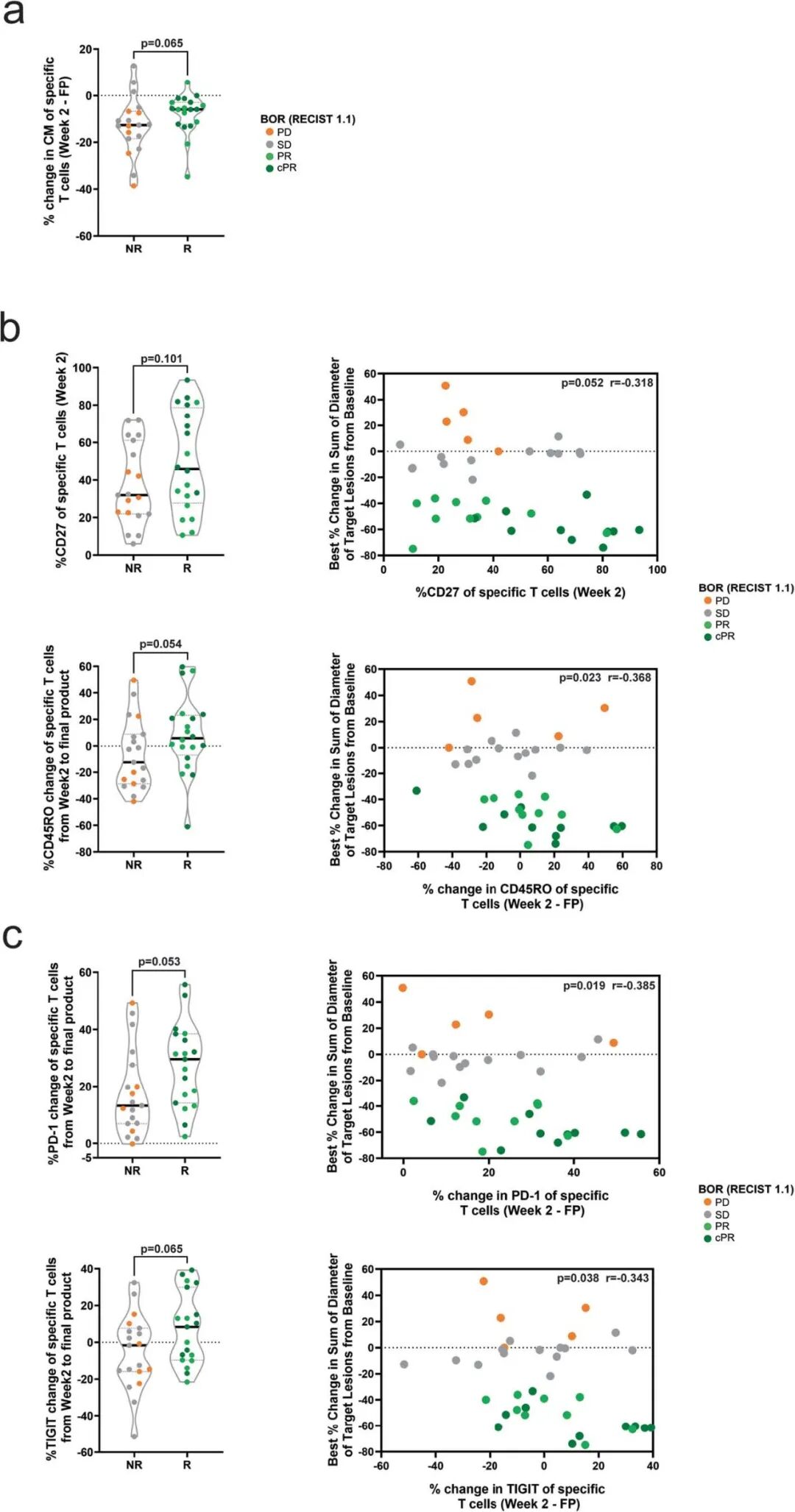
扩展图 7|输注后2周IMA203 T细胞的激活/分化状态与应答相关
a.应答者与非应答者在第2周中央记忆表型(CCR7+CD45RA−)差异。
b.第2周CD27、CD45RO表达差异。
c.第2周PD-1及TIGIT上调幅度与应答相关性。
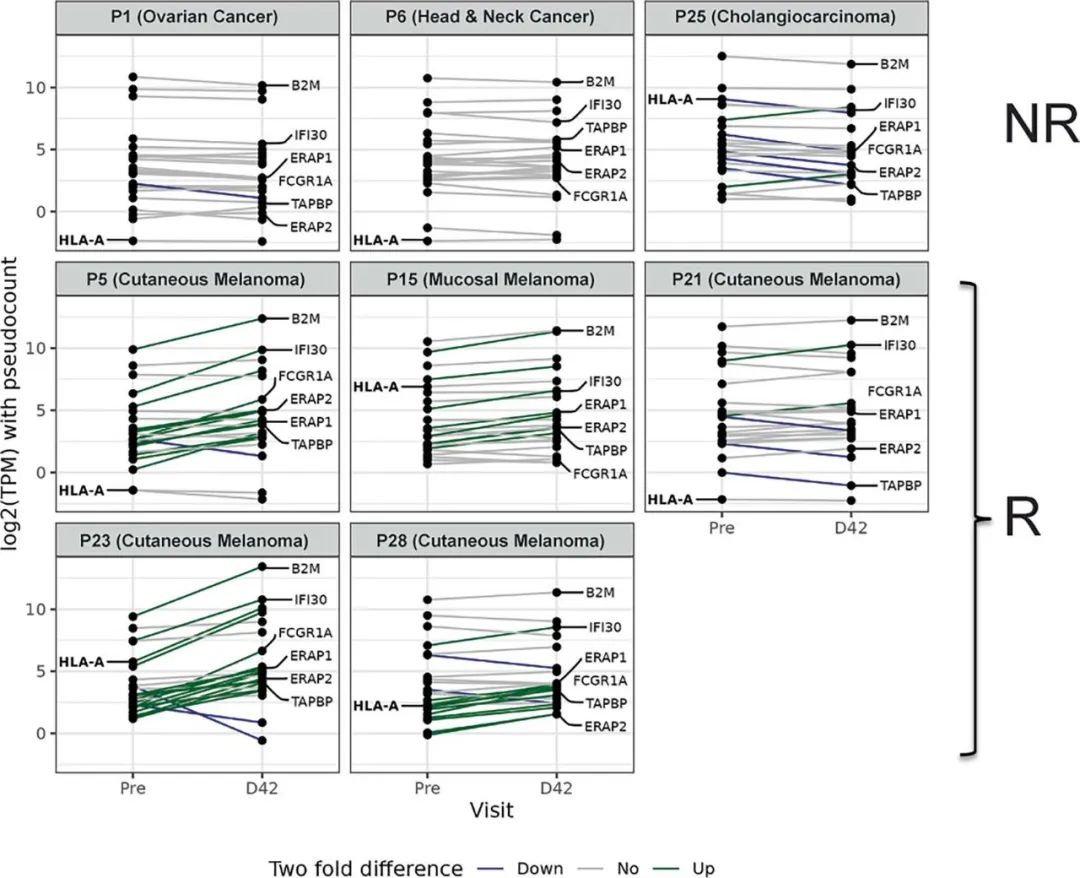
扩展图 8|应答者肿瘤微环境中抗原加工与呈递机器上调
对5例应答者与3例非应答者的配对活检RNA-seq分析,展示抗原加工与呈递相关基因在D42相对基线的表达变化。
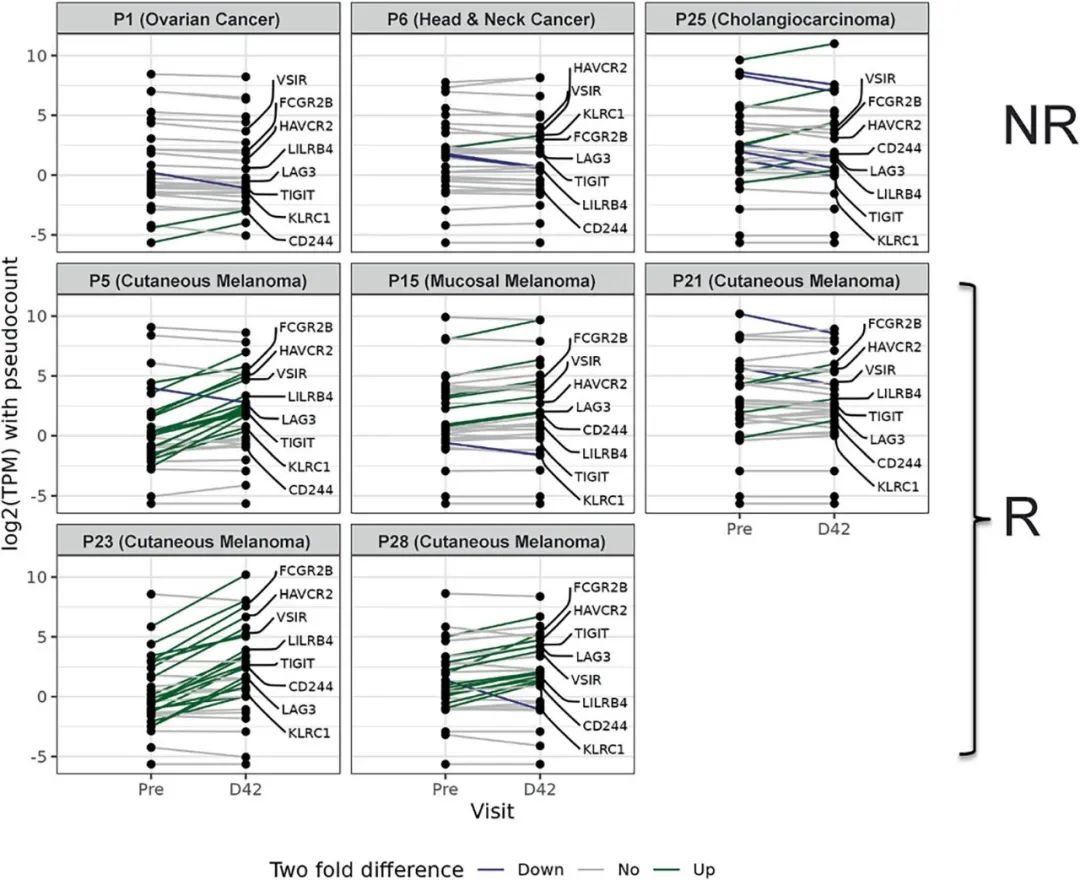
扩展图 9|应答者肿瘤微环境中出现适应性耐药信号
与扩展图8相同患者群体,展示负向免疫调控及T细胞耗竭相关基因在D42的表达变化。
参考文献:
Wermke M, Araujo DM, Chatterjee M, Tsimberidou AM, Holderried TAW, Jazaeri AA, Reshef R, Bokemeyer C, Alsdorf W, Wetzko K, Brossart P, Aslan K, Backert L, Bunk S, Fritsche J, Gulde S, Hengler S, Hilf N, Hossain MB, Hukelmann J, Kalra M, Krishna D, Kursunel MA, Maurer D, Mayer-Mokler A, Mendrzyk R, Mohamed A, Pozo K, Satelli A, Letizia M, Schuster H, Schoor O, Wagner C, Rammensee HG, Reinhardt C, Singh-Jasuja H, Walter S, Weinschenk T, Luke JJ, Britten CM. Autologous T cell therapy for PRAME+ advanced solid tumors in HLA-A*02+ patients: a phase 1 trial. Nat Med. 2025 Jul;31(7):2365-2374. doi: 10.1038/s41591-025-03650-6. Epub 2025 Apr 9. Erratum in: Nat Med. 2025 Jul;31(7):2453. doi: 10.1038/s41591-025-03731-6. PMID: 40205198; PMCID: PMC12283372.