CUSTOMER
客户中心
助力生命健康领域从基础研究到产业化的加速转化
From: Signal Transduction and Targeted Therapy IF=52.7
Abstract

Mitochondrial diseases represent one of the most prevalent and debilitating categories of hereditary disorders, characterized by significant genetic, biological, and clinical heterogeneity, which has driven the development of the field of engineered mitochondria. With the growing recognition of the pathogenic role of damaged mitochondria in aging, oxidative disorders, inflammatory diseases, and cancer, the application of engineered mitochondria has expanded to those non-hereditary contexts (sometimes referred to as mitochondria-related diseases). Due to their unique non-eukaryotic origins and endosymbiotic relationship, mitochondria are considered highly suitable for gene editing and intercellular transplantation, and remarkable progress has been achieved in two promising therapeutic strategies—mitochondrial gene editing and artificial mitochondrial transfer (collectively referred to as engineered mitochondria in this review) over the past two decades. Here, we provide a comprehensive review of the mechanisms and recent advancements in the development of engineered mitochondria for therapeutic applications, alongside a concise summary of potential clinical implications and supporting evidence from preclinical and clinical studies. Additionally, an emerging and potentially feasible approach involves ex vivo mitochondrial editing, followed by selection and transplantation, which holds the potential to overcome limitations such as reduced in vivo operability and the introduction of allogeneic mitochondrial heterogeneity, thereby broadening the applicability of engineered mitochondria.
摘要
线粒体病是最常见、最致残的遗传性疾患类别之一,具有显著的遗传、生物学和临床异质性,这推动了“工程化线粒体”领域的发展。随着受损线粒体在衰老、氧化性疾病、炎症性疾病及癌症中的致病作用被日益认可,工程化线粒体的应用已扩展至这些非遗传背景(有时统称为“线粒体相关疾病”)。由于其独特的非真核起源及其与宿主细胞的内共生关系,线粒体被认为特别适合基因编辑和细胞间移植;过去二十年中,两大前景广阔的治疗策略——线粒体基因编辑和人工线粒体转移(本综述中统称为“工程化线粒体”)取得了显著进展。本文全面回顾了工程化线粒体用于治疗应用的机制与最新进展,并简要总结了其潜在临床意义及来自临床前和临床研究的支持证据。此外,一种新兴且可能可行的方法是:先在体外对线粒体进行编辑,再经筛选后进行移植;该方法有望克服体内可操作受限以及同种异体线粒体异质性引入等局限,从而进一步拓展工程化线粒体的适用范围。
内容总结
研究目的
系统梳理“工程化线粒体”两大技术路线——线粒体基因编辑(mitochondrial gene editing)与人工线粒体移植(artificial mitochondrial transfer)——的分子机制、技术演进、临床前/临床证据,并展望其在遗传性与获得性疾病中的治疗前景。
技术路线与关键实验进展
线粒体基因编辑
1.1 工具迭代
1.2 临床前验证
人工线粒体移植
2.1 技术平台
2.2 临床前验证(部分代表性实验)
2.3 早期临床
主要结论
基因编辑适用于“突变mtDNA负荷高、器官局限、单基因”的线粒体病;移植适用于“广泛组织能量衰竭、急性损伤”场景。
AAV 是当前最有效的体内递送载体,但容量和免疫原性限制了大型编辑器;脂质/聚合物纳米载体及胞外囊泡为移植提供了安全、可放大的替代方案。
线粒体移植在急性缺血、创伤、退行性疾病中均显示显著组织修复与功能恢复;长期安全性、异体/异种来源的免疫原性仍需更多数据。
“体外编辑-筛选-自体回输”策略有望同时解决体内操作难与异质性混杂问题,成为下一步临床转化重点。
关键挑战与展望
图文摘要
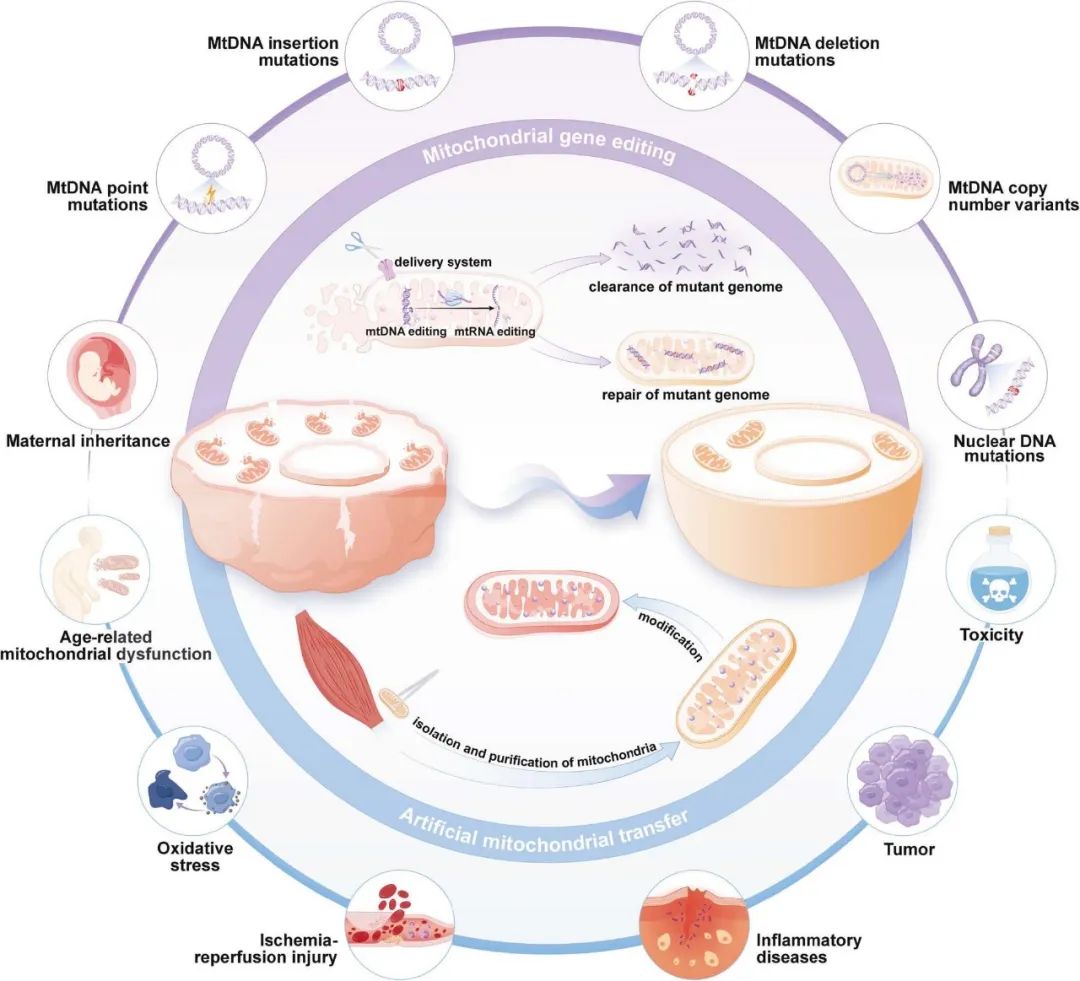
图 1. 工程化线粒体在疾病治疗中的示意图。
工程化线粒体通过两种互补策略发挥作用:线粒体基因编辑可精准清除或修复突变基因组,从而纠正线粒体缺陷;人工线粒体转移则通过补充功能正常的线粒体,恢复细胞能量代谢水平。
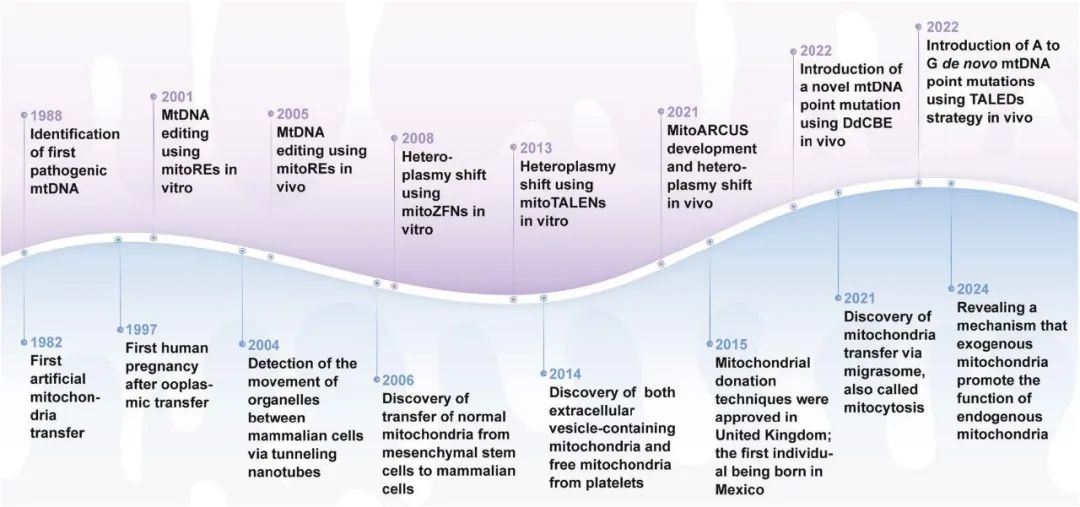
图 2. 线粒体工程发展里程碑时间线。
该时间轴总结了过去四十年来线粒体工程领域的重要进展。紫色背景部分展示线粒体基因编辑从首次发现致病 mtDNA 到使用多种核酸酶和碱基编辑工具纠正突变的演进;蓝色背景部分展示人工线粒体转移从最初的人工移植到启动大规模临床试验的演进。
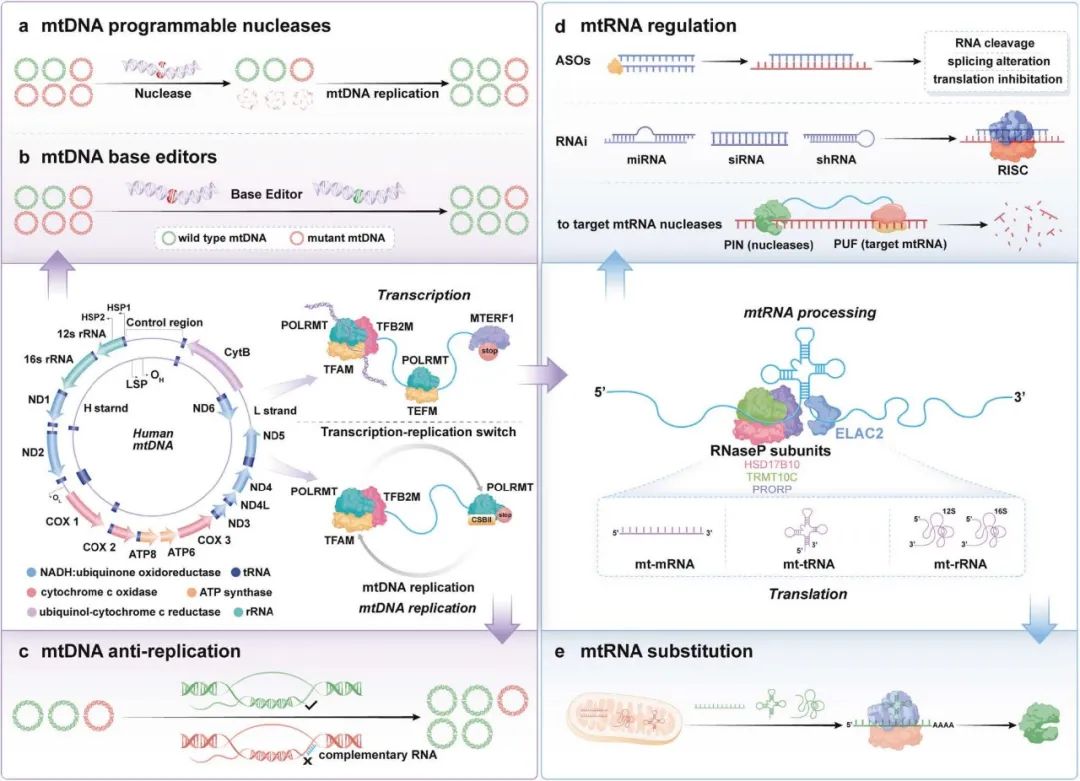
图 3. 线粒体基因编辑策略示意图。
mtDNA 复制与转录起始:TFAM 驱动 mtDNA 复制与转录,POLRMT 与 TFB2M 在启动子区域形成起始复合物。
转录延伸:TFAM 与 TFB2M 解离后,POLRMT 与 TEFM 结合,完成转录延伸,生成长链 RNA。
mtDNA 突变矫正:利用核酸酶或碱基编辑器靶向纠正突变,或通过阻断剂抑制突变 mtDNA 复制。
转录成熟:新生转录本经 RNase P 与 ELAC2 水解剪切,完成成熟。
a. mtDNA 可编程核酸酶:如 CRISPR-Cas9,可精准靶向 mtDNA 特定位点。
b. mtDNA 碱基编辑器:在无 DSB 的情况下实现 mtDNA 点突变校正。
c. mtDNA 抗复制策略:阻断突变 mtDNA 的复制。
d. mtRNA 调控:使用 ASO、RNAi 或 RNA 靶向核酸酶调节 mtRNA 表达。
e. mtRNA 替换:替换缺陷 mtRNA(mt-mRNA、mt-tRNA、mt-rRNA)以恢复正常功能。
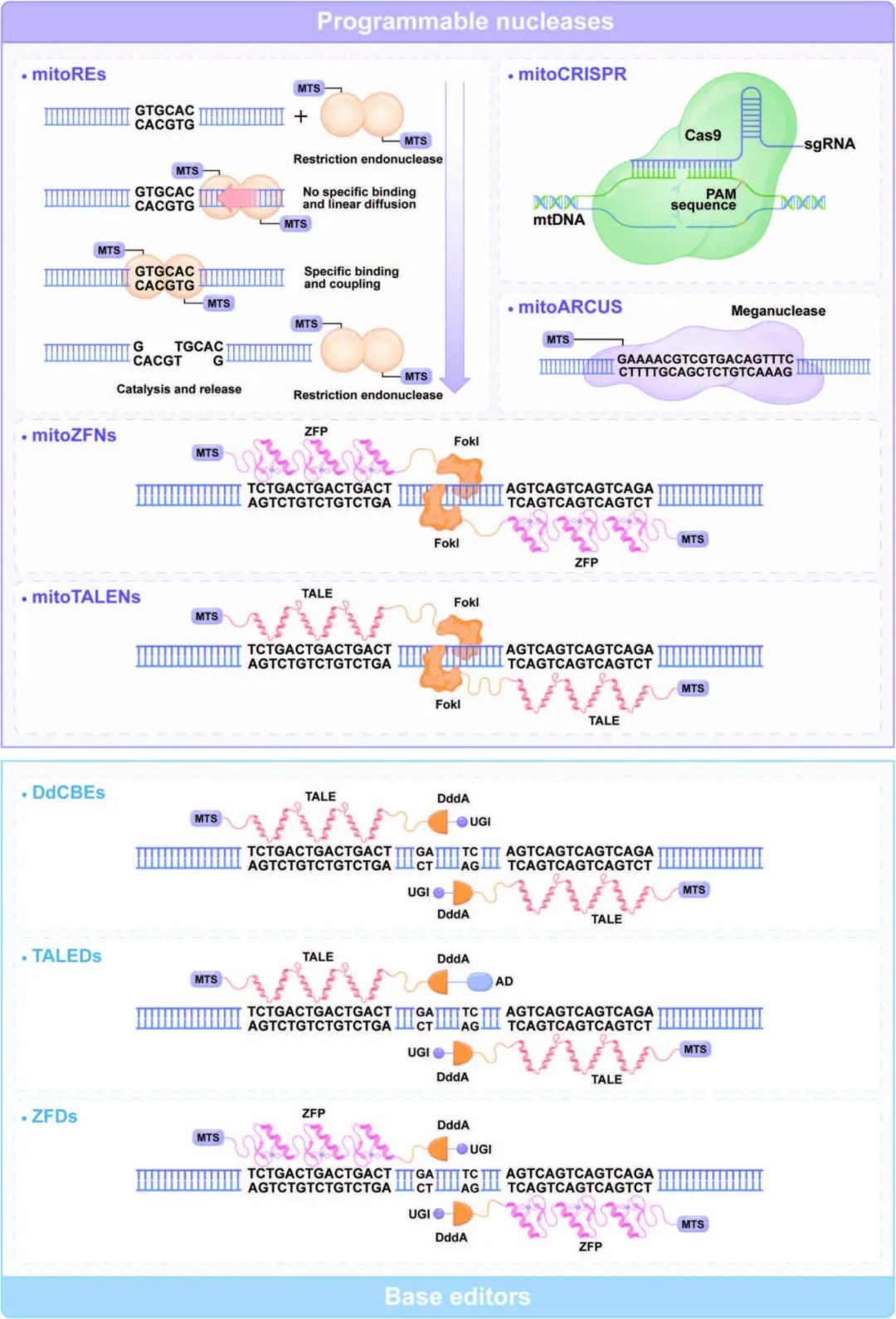
图 4. 常用 mtDNA 编辑工具的结构与功能。
紫色背景:可编程核酸酶类(mitoREs、mitoARCUS、mitoZFN、mitoTALEN、mitoCRISPR)的通用架构。
蓝色背景:碱基编辑器类(DdCBEs、TALEDs、ZFDs)的结构示意。
DdCBEs 实现 C→T 转换;TALEDs 实现 A→G 转换;ZFDs 实现 C→T 转换。
(缩略语:AD、DdCBEs、mitoARCUS、mitoCRISPR、mitoREs、mitoTALENs、mitoZFNs、mtDNA、MTS、PAM、sgRNA、TALEDs、UGI、ZFDs、ZFP 等均在原文已定义。)
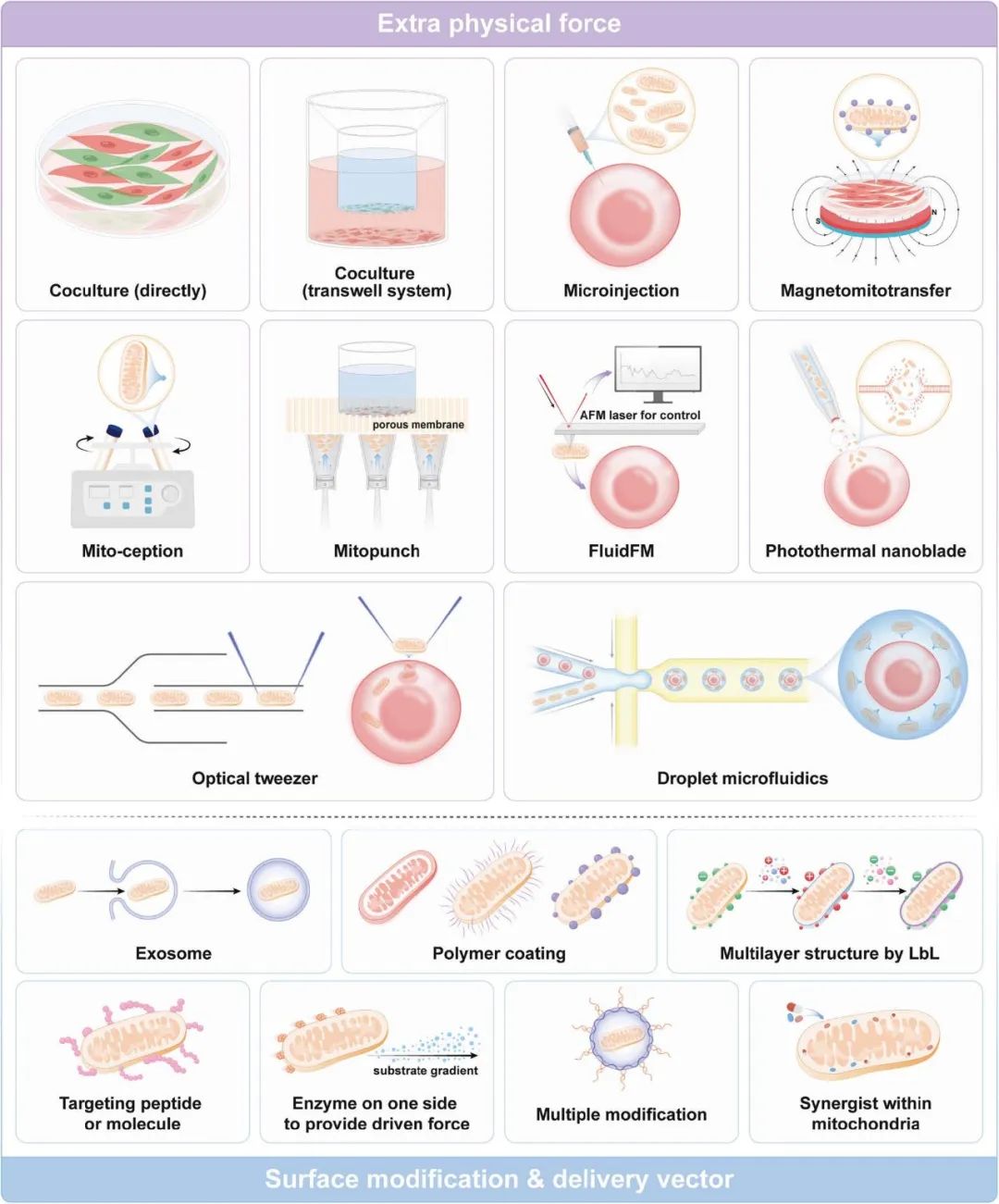
图 5. 人工线粒体转移策略示意图。
物理方法:共培养、显微注射、磁驱动转移、mitoCeption、mitoPunch、FluidFM、光热纳米刀、光镊、液滴微流控等,可借助自然细胞间转移或外加驱动力。
生化方法:利用外泌体、聚合物包覆、靶向肽等对线粒体表面进行修饰或作为递送载体,以提高转移效率。
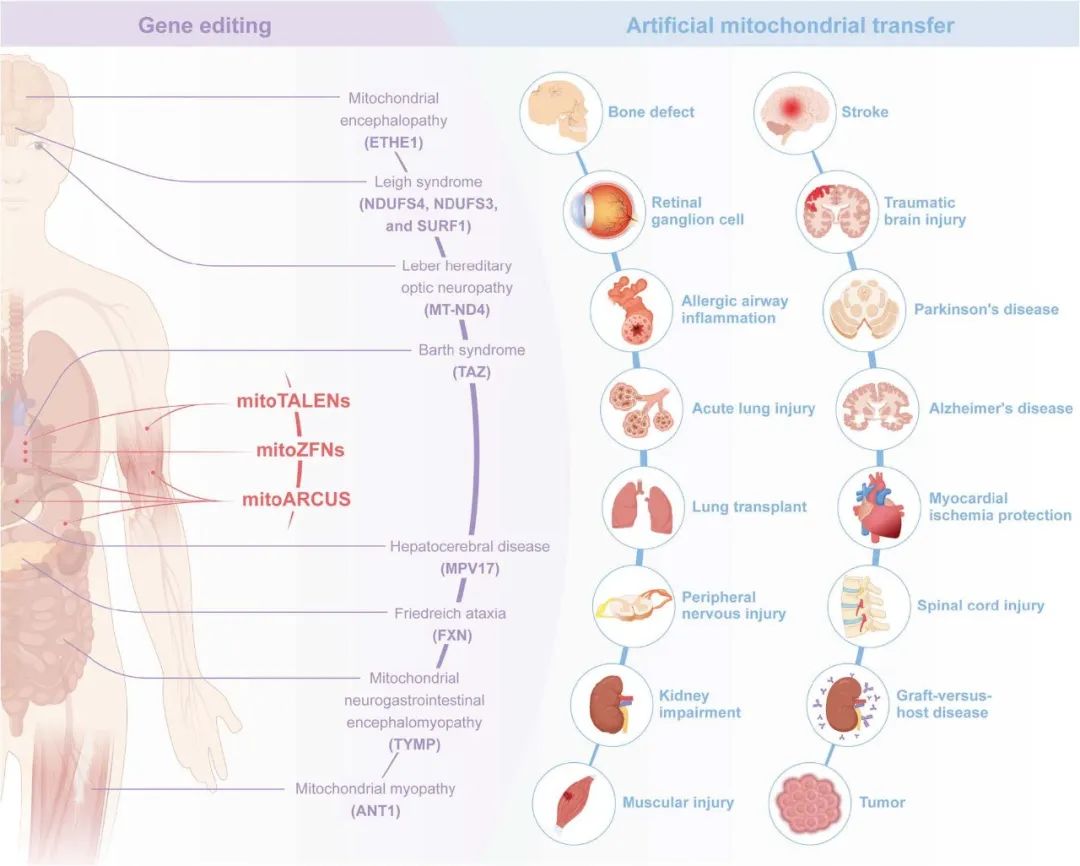
图 6. 工程化线粒体在疾病中的临床前研究概览。
红色区域:mitoTALEN、mitoZFN 与 mitoARCUS 在特定组织中清除突变 mtDNA 的体内研究。
紫色区域:针对不同突变基因所致线粒体疾病,通过核基因组编辑开展的广泛体内研究。
蓝色区域:人工线粒体转移在心血管、神经、消化、视觉、泌尿及肌肉骨骼系统疾病动物模型中取得的积极成果。
参考文献:Li M, Wu L, Si H, Wu Y, Liu Y, Zeng Y, Shen B. Engineered mitochondria in diseases: mechanisms, strategies, and applications. Signal Transduct Target Ther. 2025 Mar 3;10(1):71. doi: 10.1038/s41392-024-02081-y. PMID: 40025039; PMCID: PMC11873319.