在进行疾病治疗时,需要将药物通过口服、注射等不同的方法途径递送到人体内才能发挥作用。
而在我们日常的科学实验研究中,往往需要使用慢病毒、腺相关病毒等工具注射到动物体内研究动物机体功能及代谢路径等,以观察阐明疾病发生发展机制。
这时就需要选择一定的注射方式,今天小编给大家介绍一下动物实验中各种不同给药途径的方法步骤,供大家参考。
01 尾静脉注射
- 首先,将小鼠尾部轻轻提起,放置于鼠笼盖或实验者手背上,给予适度安抚以缓解其紧张情绪。
- 接着,将小鼠固定于适配的约束器内,确保盖子紧闭,并使尾部充分暴露;使用酒精棉球擦拭尾部,或借助温水、浴霸等方式对尾巴进行加热,促进血管扩张;
- 将尾巴拉直,使其红色静脉轮廓清晰可辨;
- 在距尾尖约三分之一处进行穿刺,若针头顺利进入,无明显阻力,表明已准确刺入静脉;
- 观察针筒内是否有回血现象,若出现回血,即可开始注射;
- 注射结束后,用无菌棉球按压针口约1分钟以帮助止血。
- 最后,取出小鼠,轻柔地放回原笼内进行恢复。
补充说明:
参考文献 “AAV9 supports wide-scale transduction of the CNS and TDP-43 disease modeling in adult rats” 指出,对于6周龄、体重约150克的成年大鼠,在尾静脉注射AAV9(如AAV9-TDP-43或AAV9-GFP)时,推荐剂量范围为每千克体重3×10¹³~1×10¹⁴ v.g。注射液体积应严格控制在标准限度内,避免超量,例如对于体重250克的大鼠,建议注射体积为250~500μL。就150克左右的年轻成年大鼠而言,推荐使用的注射体积约为200μL。
02 颞/面静脉注射
- 首先,将一只仔鼠(幼龄小鼠)直接置于湿冰上,使其低温麻醉,时长控制在30~60秒之间。由于过度暴露于低温环境可能诱发一系列严重并发症,如心律失常(包括心室颤动)、组织缺氧及代谢性酸中毒,因此不宜延长冰上时间。有文献指出,该时间范围足以显著减缓小鼠的活动,从而为注射提供操作窗口。如需更深层次的麻醉状态,可考虑使用1–2%异氟烷吸入麻醉剂作为替代或补充手段。
当小鼠仍处于低温麻醉状态时,迅速准备注射装置。此时,将30μL伊文思蓝(Evans Blue)染料装入注射器,并排除气泡备用。
- 待小鼠完全进入麻醉状态(即虽仍保持自主呼吸,但在冰面上已无明显运动反应)后,将其转移至显微镜下进行操作。若操作者为右手操作,应将小鼠头部朝向左侧,使注射部位靠近操作者右手。左手辅助固定头部位置:将食指置于枪口区域,中指扶持耳塞尾端,使耳塞被夹持于两指之间,便于稳定。
- 接下来,需识别目标血管。首先观察耳前区域的表浅毛细血管,在操纵皮肤时会随之移动。注意:毛细血管本身并非注射靶点,其存在主要用于辅助定位。注射目标为其下方的静脉血管,常表现为一条不随皮肤移动的暗色阴影,即颞静脉,其走向由背侧向腹侧延展,最终汇入颈静脉。
- 在注射过程中,应将针头以斜面朝上方式缓慢插入颞静脉。如针尖已正确置入血管内,常可通过皮肤清晰观察到针斜面内有血液回流填充的现象。此时缓慢推进注射器柱塞,注射过程中应密切观察染料沿小鼠面部侧静脉走向漂白的痕迹,确认药液成功注入。
- 为防止注射液回流,建议注射完成后继续将针头保留在血管内10~15秒,以稳定药液扩散并避免药剂逸出。
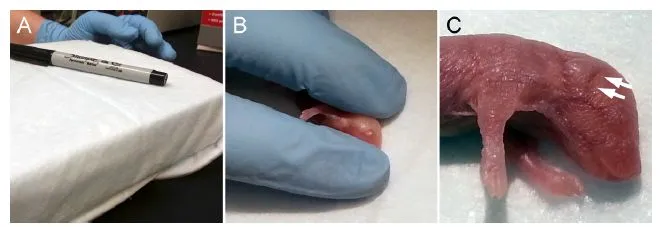
图A:临时注射平台;图B:手指位置;图C:注射位点。
03 腹腔注射
- 将小鼠尾部从笼中提起,轻轻放置于手背上,给予适当安抚,以减少应激反应。
- 使用左手固定小鼠:拇指与食指夹住其颈背部,无名指与小指稳住尾部及后肢,使其腹面朝上,头部略低。
- 右手持注射器,从小鼠下腹部距腹白线约0.5cm处进针,针头与腹面呈约30°夹角。刺入时动作应迅速但柔和,初始阶段可感受到皮肤张力,随后阻力骤减,提示针头已进入腹腔。回抽无回血表明未刺穿内脏,可进行注射操作(注意:进针深度不应超过1cm,避免损伤内脏器官)。
- 注射完毕后,缓慢拔出针头,并略作旋转,以减少药液外漏的可能。
- 操作完成后,将小鼠安全放回笼中,继续饲养并观察其状态。
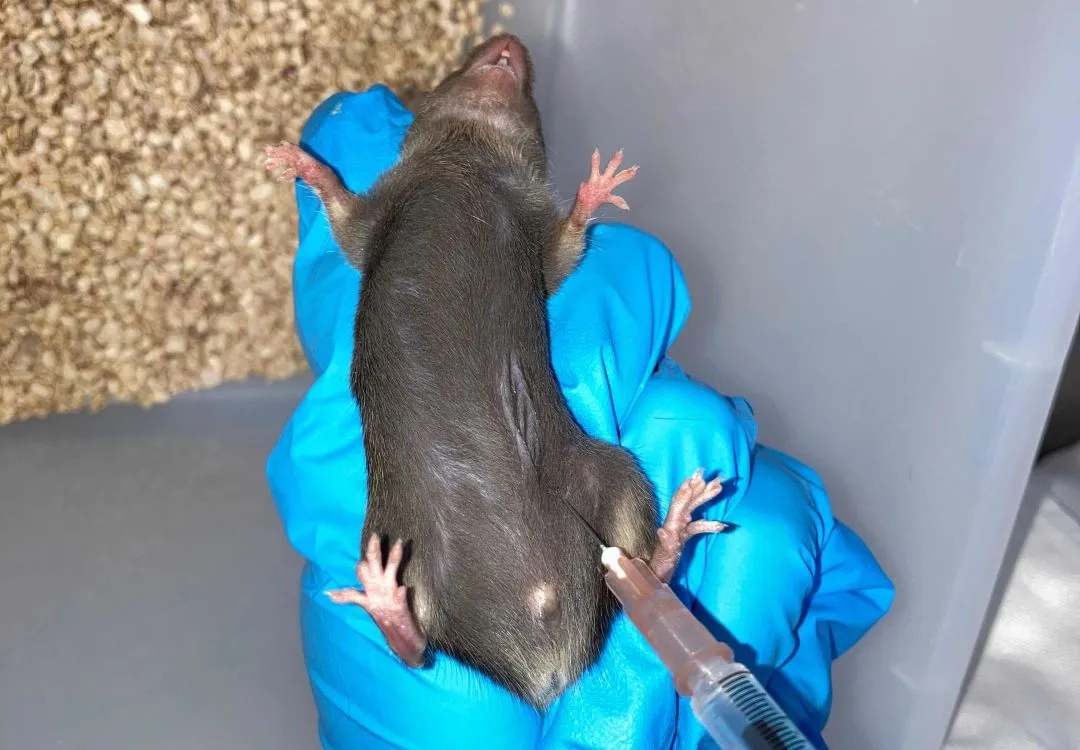
小鼠腹腔注射示意图
04 视网膜下注射
- 成年小鼠(6~8周龄)采用腹腔注射方式进行麻醉。
- 使用含有0.5%去氧肾上腺素与0.5%托吡卡胺的滴眼液进行瞳孔扩张处理。
- 准备已装载1.5~2μL病毒液的微量注射器备用。
- 为便于操作,先打开眼睑,使眼球赤道部分暴露,并在显微镜下进行观察。整个注射过程中需保持赤道区域裸露,以防止操作期间针头移位。可用手指轻托眼眶边缘以稳定眼球位置。
- 在角膜表面滴加一滴眼用粘弹性材料,用于润滑和保护眼球表面。
- 在角膜顶部放置小型圆形盖玻片,以便清晰观察视网膜区域。
- 使用30G,1/2无菌针头在角膜缘后方预穿一个小孔,右眼建议在下方穿刺,左眼则选上方部位,方便后续操作。
- 将33G钝头针经穿孔处缓慢插入视网膜下腔,直至感觉到轻微阻力,提示针尖到达目标层。
- 缓慢注入病毒载体(如1×10⁶TU/μL),操作需平稳,以防视网膜震动或组织损伤,注射完毕后轻柔拔针。
- 注射结束后,在显微镜下检查视网膜是否形成注射性水泡,同时确认无出血情况发生。
- 操作完成后,轻合眼睑覆盖注射区域,促进恢复。
- 最后,将小鼠放回笼中饲养,持续观察其活动情况,确保其状态稳定。
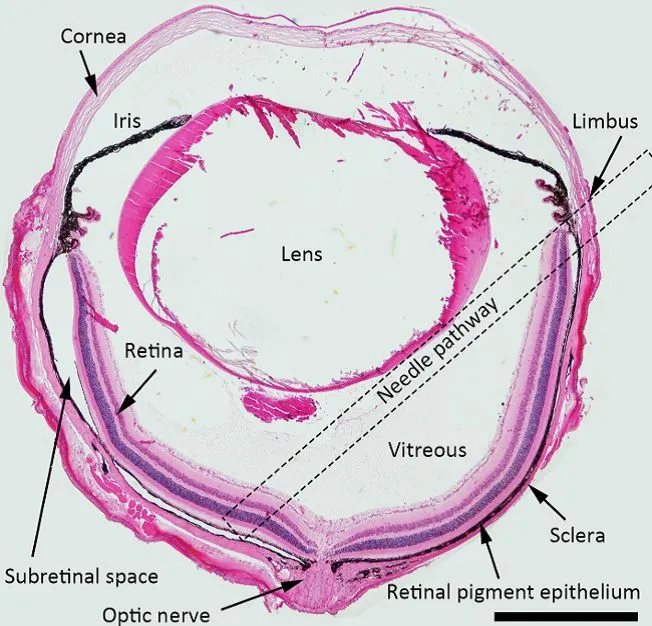
眼球组织的横断面染色切片图
05 脑立体定位注射
第一部分:术前准备
实验所需器材包括:脑立体定位仪、常规外科手术工具、颅骨钻、微量注射器、干棉球、1%戊巴比妥钠、生理盐水、1mL注射器及实验用小鼠。
首先,使用1%戊巴比妥钠对小鼠进行腹腔注射麻醉,推荐剂量为80mg/100 g体重。注射后取出小鼠,静置约5~10分钟以待麻醉起效。确认麻醉充分后,使用剃毛器清除其头部毛发。
第二部分:小鼠固定与开颅
将麻醉并剃毛处理后的小鼠固定于脑立体定位仪中。
固定操作如下:先将门齿卡入齿夹,轻轻下压横杆以稳固头部。调整适配器的高度与前后位置,使左右耳杆能够顺利插入小鼠外耳道。左手轻托头部,将左侧耳杆插入耳道后,再对准U型开口中心,依次锁紧两侧耳杆与门齿夹螺丝,确保头部稳固不晃动。
固定确认标准为:鼻尖对准中线、头部平衡稳定、提起尾部不脱落,同时目测大脑位于水平状态。随后使用剃刀或脱毛膏处理手术区域,再用手术刀纵切头皮,剥离覆盖颅骨表面的结缔组织,充分暴露前囟与后囟。
参照小鼠脑图谱,依据Bregma点为原点,测量目标脑区相对于Bregma与Lambda的前后、左右及深度坐标。根据设定参数,操作者将颅骨钻移动至对应位置,开孔尺寸以不影响操作为原则尽量缩小。
钻孔过程需小心:使用钻头缓慢打磨目标部位的颅骨,当骨质变薄至出现裂缝时,使用注射针头轻轻挑破骨膜。过程中如出现出血,可用细长医用棉条吸尽。切记控制钻头深度,避免穿透后伤及脑组织。
第三部分:病毒注射
使用PBS缓冲液清洗5μL微量注射器3~5次以去除残留物。
装载病毒前,先吸取1μL空气,再吸入1μL稀释后的病毒液,确保药液能顺利注出。完成后在空气中测试注射器通畅性。
将微量注射器安装至注射泵,并调整其位置使针头正对钻孔区域。以颅骨表面为基准(Z=0),缓慢下调针头,确保其进入脑区的深度符合预先设定坐标。针尖应始终保持垂直,注射位置须与钻孔点完全对齐。
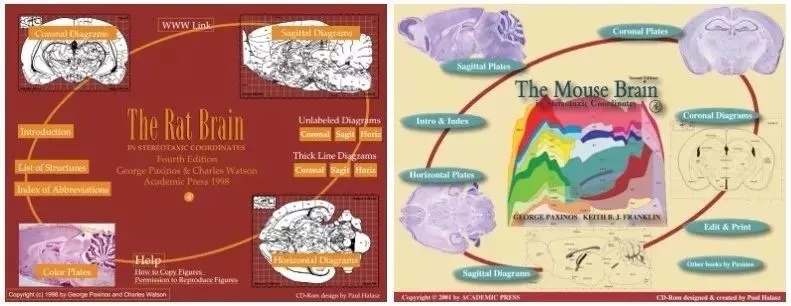
大、小鼠脑立体定位注射图谱
06 肌肉注射
- 在进行注射前,需对实验动物进行适当固定,确保其中一侧后肢自由且稳定,以利于顺利注射。为避免动物在操作过程中挣扎导致注射针伤及肌肉,建议由两人协作完成固定操作。具体固定方式可参照文献 “Manual Restraint and Common Compound Administration Routes in Mice and Rats”。
- 注射时,针头应垂直进入皮肤,选择适配尺寸的注射器与针具。将针头以接近针斜面的角度插入动物股四头肌(位于大腿前侧)或大腿外侧肌肉团,缓慢注入药物。应避免注射至后腿肌群,以免损伤坐骨神经。
- 若需进行多次肌肉注射,应交替左右腿注射,以降低局部组织损伤的风险。
07 皮下注射
- 对实验动物进行限制时,应确保动作稳固但不过于紧迫,以便皮肤可自由移动,利于后续注射操作。
- 若皮下注射后动物需进行常规处理操作,建议避开颈背区域,改选背部臀区或侧腹部进行注射。如需进行多次皮下注射,应轮换注射部位,以避免局部组织刺激或损伤。
- 抓住目标部位的皮肤,轻轻向上提拉,使其形成类似“帐篷”的结构,便于针头插入。
- 选择合适规格的注射器与针头,将针以30°至45°角插入被提起的皮肤皱褶中。注射时应与提皮的手指方向平行,并尽量远离手指,以确保操作安全。
- 若注射成功,注射部位皮下会出现明显隆起的小肿块。操作完成后,可轻压注射点片刻,以防止药液回流。
08 皮内注射
- 对于皮内注射,通常将动物剃毛以便可以看到皮肤;
- 用于多次皮内注射的动物的约束可能是困难的。在这种情况下,化学镇静可能是必要的;
- 将适当大小的针头以15-30°的角度插入皮肤。针头不要插入很远,注射遇到阻力即可。另一种方法是在注射部位附近轻轻捏住皮肤,并以非常小的角度插入针头。这在小鼠中很有用,因为它可以防止它们在注射过程中移动;
- 如果注射成功,将会看到一个小疱。它会比周围的皮肤更苍白;
- 注射后,轻轻施加压力以防止回流。
09 灌胃
- 胃内灌注应仅在清醒状态下进行,避免对麻醉或镇静状态下的动物操作,以降低误吸风险。
- 选用尺寸合适的球头口服灌胃针。该类针具末端为圆球状,可有效防止误入气管。针头所需长度可通过将动物垂直固定,从口角向下沿身体方向测量以确定。
- 将动物垂直约束,使头部与躯干在同一直线上,有助于拉直食道,从而便于喂食针顺利通过。
- 将球头针缓慢插入口腔,置于舌面之上。当针头位于合适位置后,调整注射器方向,使其指向上方,同时轻压上颚,使动物鼻尖朝向天花板。在大鼠操作中,针头通过咽部时可能需略作方向调整。若操作中感受到明显阻力,表明进入角度或路径需重新调整。
- 将针头缓慢送入目标深度,操作过程应顺畅无明显阻碍。若动物出现喘息、呛咳或针头推进受阻,需立即终止操作并将针头拔出,防止造成损伤或误吸。

10 鞘内注射
- 首先,剃除小鼠腰背部的毛发,并使用75%酒精棉球对操作区域进行充分消毒。
- 将小鼠引导进入棉质手套中,左手固定动物体位,确保髂脊背部充分暴露。右手持29G注射针,待小鼠安静后,准确定位髂脊位置。根据不同品系小鼠的解剖特征:ICR小鼠的L5椎间隙几乎与髂脊处于同一水平,L6椎间隙位于髂脊尾侧约3mm处;而C57BL/6小鼠的L5椎间隙距髂脊约1.5mm,L6椎间隙则约为4mm。
- 在靠近中线的位置,以30°~45°角度将针头刺入皮肤,并沿髂脊水平向尾侧推进,插针点约为ICR小鼠后移3mm、C57BL/6小鼠后移4mm处。若L6椎间隙无法顺利进入,可适当调整进针角度,沿棘突与乳突间的沟槽轻柔向前移动针尖,直至穿入L5椎间隙,通常可将针尖推进椎管约5mm深。
- 针头进入椎管后,注入10μL药液。若观察到小鼠尾巴发生颤抖或突然甩动,表明进针准确,药液已注入椎管。
补充说明:该操作方法成熟可靠,过程无需麻醉处理,不干扰动物的后续行为学测试,刺激程度较低,能够有效降低对实验数据的干扰。
11 脊神经内注射
- 实验前一天,需对健康小鼠进行禁食禁水处理,为脊神经结扎术做好生理准备。
- 实验当天,先剃除小鼠背部毛发,充分暴露皮肤表面。随后采用异氟烷吸入麻醉,待其进入稳定麻醉状态后进行下一步操作。
- 动物麻醉完全后,先使用碘伏进行初步消毒,再用75%酒精棉球二次清洁。选取髂脊中线偏左约1cm处作为切口位置,使用11号手术刀片纵切皮肤,切口长度约为1cm。
- 紧接着,在腰背部中线略偏外侧处继续分层剥离。操作时使用弯镊沿脊柱方向进行钝性分离,显露第六腰椎横突,并使用棉球清除其周围组织。随后以尖镊剪断横突,暴露出目标神经。利用玻璃电极分离出第五腰神经,用6-0丝线完成结扎。接着,采用微量注射器在神经外膜下,沿神经走向缓慢注射试剂。
- 注射过程中应保持匀速,以避免损伤。注射完毕后,剪去多余缝线,将神经复位,再依次缝合肌肉和皮肤。术后使用碘伏进行再次消毒,确保伤口清洁。
- 手术结束后,将小鼠安置在温暖环境中,待其自然苏醒。
注意事项:操作过程中需持续监测小鼠呼吸频率与深度,避免因麻醉过度引发呼吸抑制或死亡等风险。
声明:本文使用图片来源于网络和文献,如有侵权请联系删除。




