CUSTOMER
客户中心
助力生命健康领域从基础研究到产业化的加速转化
葡萄糖钳夹术是用来探究胰岛素敏感性和胰岛分泌功能的一项新技术,该技术自1979年DeFronzo首先应用于人胰岛B细胞功能检测以来,已经越来越受到国内外研究者的广泛关注。葡萄糖钳夹术按胰岛素和葡萄糖的输注量大体可以分为三种,一种为高胰岛素-正常葡萄糖钳夹术(hyperinsulinemic euglycemicclamp),又称正常葡萄糖-高胰岛素钳夹术,简称正糖钳;一种为高葡萄糖-胰岛素钳夹术(hyperglycemicclamp),又称为胰岛素-高葡萄糖钳夹术,简称高糖钳;还有一种为低葡萄糖钳,主要用于研究胰岛素介导的低血糖反应与对抗调节机制。高糖钳能全面反映胰岛B细胞对葡萄糖以及组织对胰岛素的敏感性,是评估胰岛B细胞功能的金标准,现就正常葡萄糖-高胰岛素钳夹术做一介绍。
一、实验目的
正常葡萄糖-高胰岛素钳夹术主要用于研究外源性胰岛素对机体组织的作用,反映机体对外源性葡萄糖的代谢情况,它是检验机体胰岛素敏感性(IS)的金标准。
二、实验原理
正常葡萄糖-高胰岛素钳夹术的原理是通过持续输注可控浓度及速率的外源性胰岛素和葡萄糖,达到胰岛素-葡萄糖代谢平衡状态,在血浆胰岛素高于生理水平时,内源性葡萄糖产生几乎完全被抑制,此时可用葡萄糖消失率作为评价外周组织对IS的指标,从而了解葡萄糖在细胞内的代谢状况。
三、实验准备
1.仪器与试剂
(1)微量输液泵。
(2)血糖自动分析仪。
(3)取血用的毛细虹吸管,1.5mlEP管(内含血糖测定试剂),标准液,清洗液仪器。
(4)20ml注射器2只,肝素帽1个,1ml注射器4个,动静脉导管各1根,1号线若干,鼠板及皮筋5根,棉棒若干。
(5)手术器械:剪刀、眼科剪、眼科弯镊各2把,止血钳2把,弯盘1个等。
2.液体配制
(1)肝素的配置:将肝素原液(1.25万U/2ml)配成50U/m肝素液。取肝素原液(浓度1.25万U/2mg)2支,500m生理盐水1瓶,用5ml 注射器从生理盐水中抽出 4ml生理盐水,弃掉,将肝素注人剩余生理盐水中。混匀,放人4℃冰箱贮存,备用。
(2)胰岛素配制:将胰岛素原液诺和灵R40U/ml,配成1U/ml胰岛素液。
方法1:配制100ml 2.5ml诺和灵 R+97.0ml生理盐水+0.5人血白蛋白,混匀即可。
方法 2:配制 50ml 1.25ml诺和灵 R+48.5ml生理盐水+0.25 人血白蛋白,混匀即可。
注:如无白蛋白,则多加入诺和灵R20%,白蛋白在此起润壁作用,避免胰岛素贴壁,从而减低胰岛素浓度,
(3)葡萄糖溶液配置:将50%葡萄糖溶液(10g/ml)配成20%葡萄糖溶液。
方法1:配制100ml:40ml 50%葡萄糖十60ml蒸馏水,混匀即可。
方法2:配制50ml:20ml 50%葡萄糖+30ml蒸馏水,混匀即可。
3.校对微量泵 档位1时,输注率为0.707ml/h:档位2时,输注率为(0.707ml/h)X2:依此类推,档位n时,输注率为(0.707ml/h)Xn。
选择任一档位。例如,档8速率为5.66ml/h,30分钟内应为2.83ml,取一烧杯,接液体前称重,接液体后重新称重,相减得克数,假设水为1g/ml,克数即等于毫升数。刻度毫升数/实际的毫升数=泵系数,以后求实际的毫升数-刻度毫升数/泵系数。
例如:
泵A 开始重量 结束重量 差值 刻度数/实际数
档8-5.66ml/h 30分钟 15.114 17.186 2.281 1.2407
档8=5.66ml/h 30分钟 15.117 18.058 2.941 0.9623
档16=11.3ml/h 30分钟 18.058 23.990 5.932 0.9525
档12=8.49ml/h 30分钟 23.990 28.689 4.699 0.9034
以上4次结果平均数得出:泵A系数为1.01473。
四、实验步骤
(1)对实验鼠空腹8小时,备用,采空腹血糖。
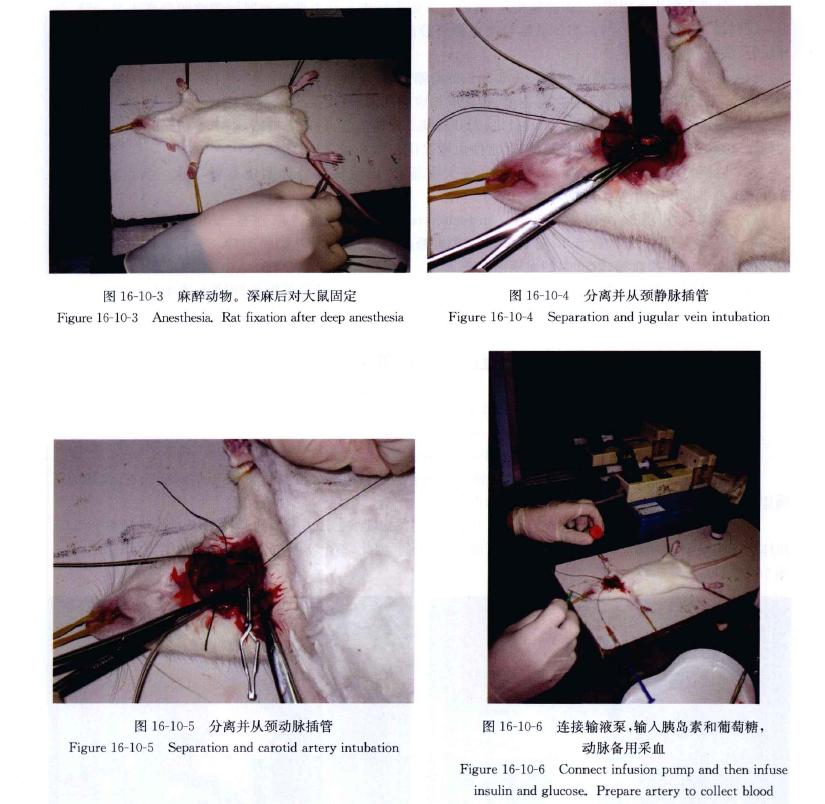
(2)用鼠板固定鼠,颈部皮肤剪毛,酒精消毒术区,用组织剪剪开右侧颈部皮肤,弯镊分离皮下组织,暴露颈静脉,分离出约1cm血管。远心端结扎,近心端穿线备用。备约15cm导管,1ml注射器充入肝素液,眼科剪成 45°剪一倾斜小口,穿人导管,远心端结扎。
(3)分离左侧皮下组织(右颈静脉稍左,可以以腺体为标志),从斜肌与直肌间隙之间分离出颈动脉,外裹一层鞘模,与迷走神经伴行,将颈动脉与迷走神经分离,动脉远心端结扎,近心端上动脉夹,穿线备用,剪开血管,插管,远心端结扎。
(4)取2个20ml注射器,一个吸 20ml 20%葡萄糖液,放在微量泵上,注意气泡排空,另一个注射器先吸白蛋白,润管,使白蛋白涂布于注射器内壁,再抽取相应胰岛素[公式:NS/胰岛素原液=1.5/体重(kg))
(5)测量空腹血糖,若大于5.5mmol/1,则开启胰岛素输液泵,进行降糖;若小于 4.5mmol/L,则开启葡萄糖输液泵,进行升糖。一切调控目的,尽量使血糖保持在 4.8~5.2mmol/L。
(6)以恒定的速率[10mU/(kg·min))输注胰岛素,以后每5分钟测定血糖1次。当血糖值低于5.0mmol/L时,开始输注 20%葡萄糖。
(7)调整葡萄糖输注速率(glucose in-fusion rate,GIR)使血糖控制在 5.0mmol/L左右(4.8~5.2mmol/1)。每隔5分钟或者 10 分钟测量一次血糖,尽快是鼠血糖达到稳态(4.8~5.2mmol/L)。稳态后,继续记录5~6次血糖,取此时的血糖输注率。
(8)计算胰岛素敏感性。按公式 GIR[mg/kg·min]=稳定期葡萄糖平均输入速率(mL/h)X178/[60x体重(kg)x泵校正系数进行计算。
五、注意事项
(1)在胰岛素配液过程中,要考虑到胰岛素的吸壁作用。
(2)在使用微量泵之前一定要进行校对,求出泵的系数。
(3)实验开始前,待实验鼠应该空腹8小时,备测空腹血糖。
(4)血糖达到稳态是整个实验过程的关键。影响血糖达到稳态有很多因素,如鼠的麻醉状态,仪器的正确连接、管道是否畅通、外界环境的温度和噪声等。
(5)实验一般2小时能达到稳态,再持续1小时便可结束实验。随着时间的延长,葡萄糖的输注率会增高。机体会达到一个新的稳态,估计是机体应激后的适应过程。因此,整个实验应该在3小时内结束(图 16-10-1~图16-10-6)。